Midollo fissato e lipoma sacrale
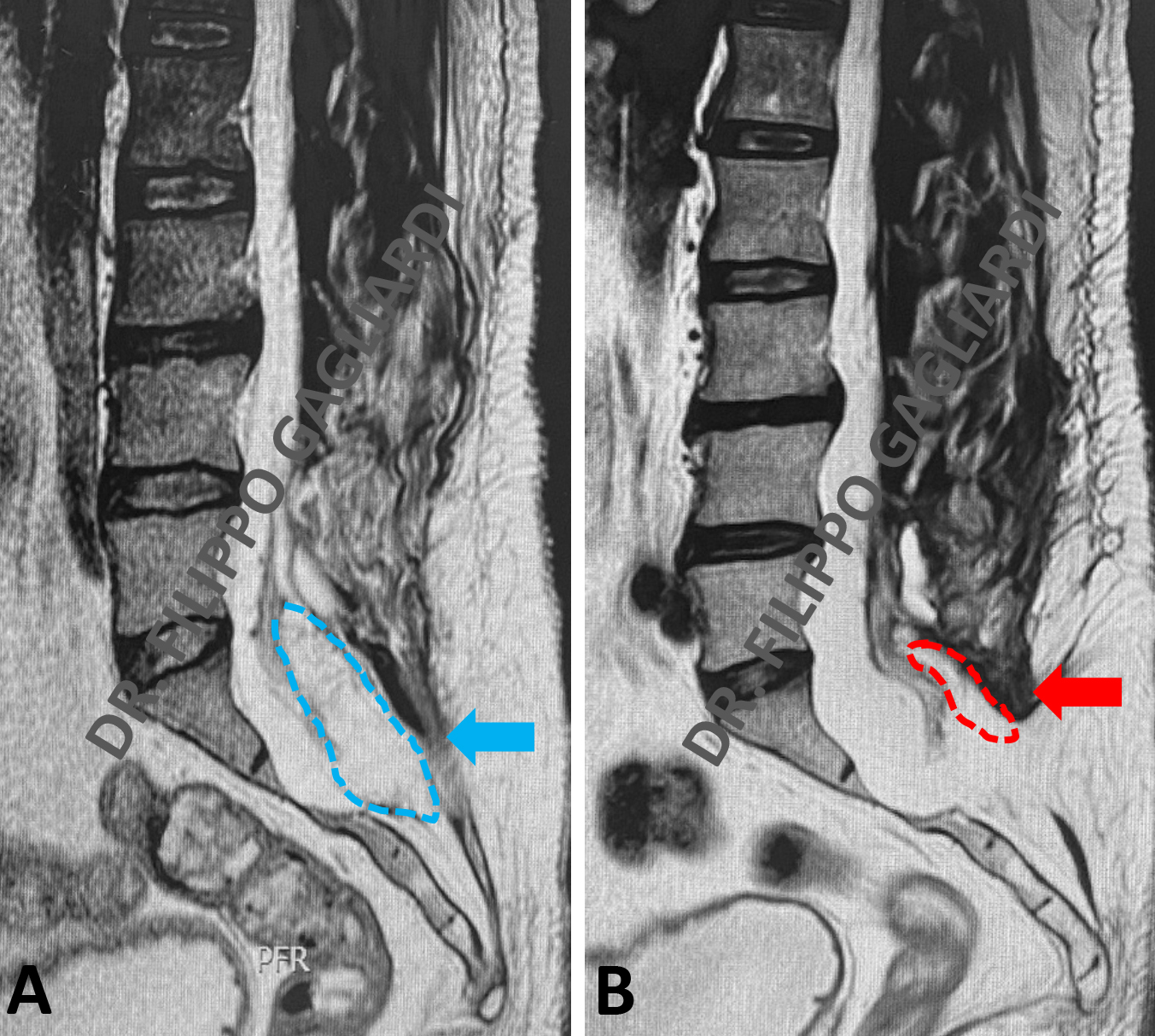 Patologia malformativa spinale Caso di paziente con tethered cord (midollo fissato) (midollo spinale fissato da un cordone fibroso a livello dell’osso sacro) associato ad un lipoma intradurale (tumore benigno di tessuto adiposo) a livello delle ultime radici spinali che presiedono al controllo degli sfinteri (freccia azzurra, Figura A).
Patologia malformativa spinale Caso di paziente con tethered cord (midollo fissato) (midollo spinale fissato da un cordone fibroso a livello dell’osso sacro) associato ad un lipoma intradurale (tumore benigno di tessuto adiposo) a livello delle ultime radici spinali che presiedono al controllo degli sfinteri (freccia azzurra, Figura A).
Midollo fissato
È una condizione in cui il midollo spinale rimane ancorato verso il basso da un cordone fibroso (filum terminale) che lo stira verso il basso e ne causa sofferenza. In condizioni di normalità il midollo spinale termina a livello della prima vertebra lombare (cono midollare), nel caso presentato il midollo termina a livello della quinta vertebra lombare, perché stirato verso il basso. La paziente si presentava in ospedale per incapacità ad urinare (ritenzione urinaria) e perdita di feci (incontinenza). Veniva sottoposta ad intervento di disancoraggio midollare (sezione del cordone fibroso) e decompressione delle radici nervose mediante asportazione sub-totale del lipoma. L’intervento veniva eseguito sotto monitoraggio neurofisiologico per preservare la funzione dei nervi. La RM post-operatoria (Figura B) dimostra gli esiti dell’intervento con riduzione significativa del lipoma e detensione dei nevi e del midollo spinale (freccia rossa, Figura B). Nel post-operatorio si è assistito ad un miglioramento della funzione sfinterica della paziente.
Mielomeningocele e schisi vertebrale
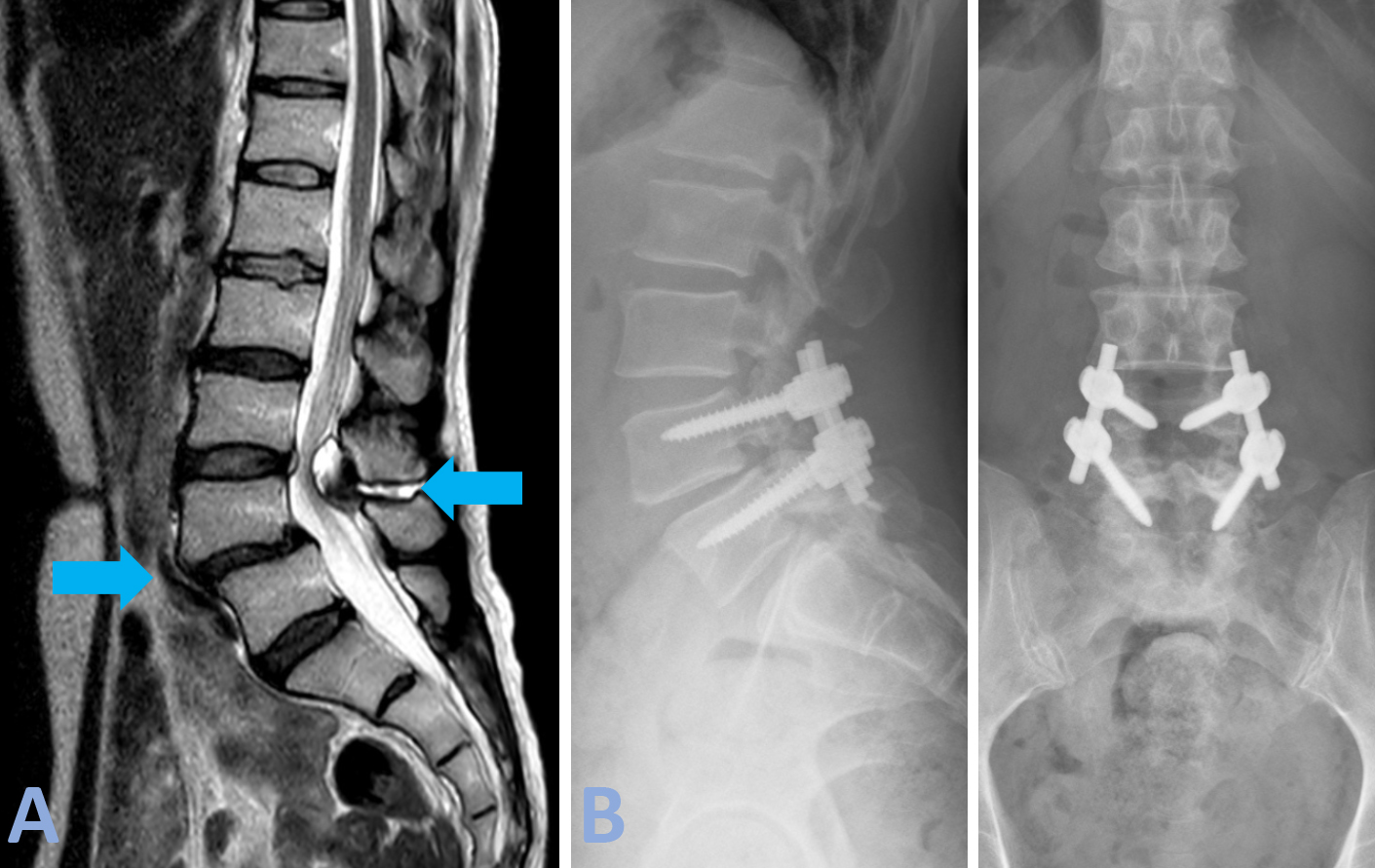 Patologia malformativa spinale Caso di disrafismo spinale condizionante grave instabilità vertebrale. Conseguente scivolamento della quarta vertebra lombare in avanti rispetto alla quinta vertebra lombare (anterolistesi) (freccia azzurra di sinistra, Figura A).
Patologia malformativa spinale Caso di disrafismo spinale condizionante grave instabilità vertebrale. Conseguente scivolamento della quarta vertebra lombare in avanti rispetto alla quinta vertebra lombare (anterolistesi) (freccia azzurra di sinistra, Figura A).
Schisi vertebrale
Lo scivolamento è dovuto dall’assenza delle strutture posteriori delle vertebre che ne assicurano la stabilità meccanica. Ad ulteriore complicazione della situazione vi era la presenza di una malformazione delle meningi (membrane che contengono le radici spinali) (meningocele) (freccia azzurra di destra della Figura A). La Paziente si presentava con intenso dolore lombare (lombalgia) e dolore alla gamba destra (sciatalgia). Si procedeva ad intervento di artrodesi (stabilizzazione) vertebrale con riallineamento vertebrale e decompressione delle strutture nervose mediante laminectomia e plastica durale del difetto (mielomeningocele) (freccia rossa della Figura B). Nel post-operatorio si è assistito ad una completa risoluzione della sintomatologia dolorosa della paziente.
Sindromi dolorose spinali
Le sindromi dolorose spinali rappresentano una vasta gamma di patologie della colonna vertebrale che colpiscono diffusamente la popolazione con un'incidenza crescente. Sono responsabili della prima causa di assenza sul posto di lavoro nel mondo industrializzato. Le sindromi dolorose della colonna vertebrale hanno potenzialmente un impatto drammatico sulla qualità di vita dei pazienti, responsabili spesso di una limitazione funzionale significativa. Vista l'eterogeneità di queste patologie è fondamentale vi sia un adeguato inquadramento diagnostico anche per escludere patologie, anche gravi, di altra natura. In questo paragrafo cerco di sintetizzare le diverse entità nosologiche, dando una rapida spiegazione di ognuna di esse. È, tuttavia, fondamentale recarsi dallo specialista neurochirurgo per una corretta diagnosi e un adeguato approccio terapeutico, che varia da patologia a patologia. Spesso le sindromi dolorose spinali sono conseguenza del fallimento di precedenti chirurgie vertebrali. Questa condizione è detta Failed Back Surgery Syndrome (FBSS). E' una patologia relativamente comune nel mondo moderno. I pazienti affetti da questa sindrome dolorosa, spesso invalidante, è opportuno si rechino in un centro di chirurgia vertebrale di eccellenza come il San Raffaele di Milano per un adeguato inquadramento clinico e pianificazione terapeutica, che coinvolge sia la chirurgia vertebrale di revisione che la terapia del dolore. Da anni il Dr. Gagliardi si occupa di queste discipline e ha all'attivo numerose procedure in questo settore.
Sindrome delle faccette articolari
La sindrome delle faccette articolari è la conseguenza di una infiammazione dei processi articolari posteriori delle vertebre prevalentemente lombari. Esse infatti hanno un grado di mobilità superiore al tratto toracico della colonna vertebrale. Tipico è il dolore assiale, livello del rachide lombare, peggiorato dal riposo prolungato (tipicamente la mattina) o dalla ipersollecitazione (la sera). Movimenti di torsione ed estensione peggiorano il dolore, così come la stazione eretta prolungata o le lunghe camminate. Migliorano il dolore i movimenti di flessione anteriore del busto e l'assunzione della posizione raggomitolata o fetale. E' fondamentale poter fare una diagnostica adeguata mediante una RM e una RX del rachide lombare possibilmente in carico e con manovre dinamiche per escludere instabilità vertebrale e patologie di altra natura. Una volta accertata la causa del dolore, le terapie variano dall'assunzione di farmaci anti-infiammatori, miorilassanti, fisioterapia e nei casi più gravi infiltrazioni di farmaci a livello della faccette articolari coinvolte. Il Dottor Gagliardi effettua infiltrazioni eco-guidate dello spazio articolare e peridurali. Nei casi più gravi, quando il dolore dovesse essere refrattario a tutte queste terapie è necessario ricorrere alla chirurgia. La sindrome delle faccette articolari può coinvolgere anche il rachide cervicale. Tipici sintomi sono la cervicalgia, dolore al collo, con le stesse caratteristiche del dolore lombare appena descritto. La diagnostica prevede l'esecuzione di di una RM e una RX del rachide cervicale possibilmente in carico e con manovre dinamiche.
Dolore discogenico
Il dolore discogenico è anch'esso un dolore assiale che origina dal disco interevertebrale. Vari gradi di patologie del disco (discopatia) inducono il malfunzionamento di questo delicato organo che ammortizza le sollecitazioni meccaniche sulla colonna vertebrale. Il disco è provvisto di recettori per il dolore, pertanto quando si ammala, può essere causa di dolori importanti. Il dolore tipicamente è un dolore meccanico, peggiorato dai movimenti di torsione e flesso-estensione della colonna cosi come dalle manovre di Valsalva (sollevamento di essi a glottide chiusa, tossire). La posizione seduta protratta, così come il movimenti di flessione, peggiorano notevolmente la sintomatologia. Il movimento e il "riscaldamento" articolare migliorano la sintomatologia. Il dolore discogenico può associarsi alla sofferenza del nervo adiacente (radicolopatia) come avviene nelle ernie del disco. E' fondamentale poter fare una diagnostica adeguata mediante una RM e una RX del rachide lombare possibilmente in carico e con manovre dinamiche per escludere instabilità vertebrale e patologie di altra natura. Anche in questo caso, le terapie variano dall'assunzione di farmaci anti-infiammatori, miorilassanti, fisioterapia, TENS, ginnastica posturale e nei casi più gravi infiltrazioni di farmaci a livello dei punti grilletto (trigger). Il Dottor Gagliardi effettua infiltrazioni eco-guidate in questo ambito. Nei casi più gravi, quando il dolore dovesse essere refrattario a tutte queste terapie è necessario ricorrere alla chirurgia. Il dolore discogeno può coinvolgere anche il rachide cervicale. Tipici sintomi sono la cervicalgia, dolore al collo, con le stesse caratteristiche del dolore lombare appena descritto. Può associarsi a radicolopatia (cervico-brachialgia), come per le ernie cervicali. La diagnostica prevede l'esecuzione di di una RM e una RX del rachide cervicale possibilmente in carico e con manovre dinamiche.
Sindrome del muscolo piriforme
La sindrome del piriforme è una sindrome dolorosa molto diffusa causata dalla compressione del nervo sciatico da parte del muscolo piriforme, un muscolo stabilizzatore del bacino. Questa condizione genera un dolore simil-sciatico (spesso irradiato al gluteo e alla faccia posteriore della coscia fino al ginocchio) (sciatica tronca). Può associarsi una debolezza nei movimenti di intra-rotazione e abduzione dell'anca. La posizione seduta protratta esacerba il dolore, così come anche il salire le scale. Extra-ruotare la coscia, detenendo il muscolo evoca un miglioramento della sintomatologia. E' fondamentale poter fare una diagnostica adeguata mediante una RM per escludere patologie di altra natura. Anche in questo caso, le terapie variano dall'assunzione di farmaci anti-infiammatori, miorilassanti, fisioterapia, TENS, ginnastica posturale e nei casi più gravi infiltrazioni di farmaci a livello del muscolo. Il Dottor Gagliardi effettua infiltrazioni eco-guidate del muscolo piriforme.
Dolore lombare cronico artrosico e da instabilità
Anche detto Low Back Pain è un dolore assiale che peggiora con i movimenti di flessione ed estensione (stazione eretta prolungata, camminare, salire le scale, sdraiarsi a pancia in sù, allungarsi verso l'alto, etc.). I movimenti contro gravità evocano un dolore meccanico (e.g. alzarsi sollevare oggetti, alzarsi dalla posizione sdraiata/seduta). Date queste premesse il dolore lombare cronico è classificato in due sotto classi. Dolore lombare cronico antigravitario. Forma più frequente. E' il dolore che peggiora caratteristicamente durante i movimenti antigravitari. E' un tipico dolore meccanico, ovvero presente durante il movimento attivo della colonna.Dolore lombare cronico da carico/compressione. E' il dolore che peggiora caratteristicamente con la posizione seduta e con la flessione anteriore. E' fondamentale poter fare una diagnostica adeguata mediante una RM e una RX del rachide lombare possibilmente in carico e con manovre dinamiche per escludere instabilità vertebrale e patologie di altra natura. Anche in questo caso, le terapie variano dall'assunzione di farmaci anti-infiammatori, miorilassanti, fisioterapia, TENS, ginnastica posturale e nei casi più gravi infiltrazioni di farmaci. Il Dottor Gagliardi effettua infiltrazioni eco-guidate in questo ambito. Il dolore assiale può coinvolgere anche il rachide cervicale e toracico o dorsale. Anche in questi casi è fondamentale la diagnostica mediante RM del tratto di colonna interessata sede ventralmente completamento RX.
Coccigodinia
Anche detta dolore al coccige. Il coccige è l'ultimo tratto della colonna vertebrale. Spesso può essere oggetto di sindromi dolorose importanti, e problemi funzionali a livello del pavimento pelvico, con dolori durante le manovre di evacuazione. La coccigodinia è spesso l'esito di un trauma diretto. Fratture del coccige posso generare coccigodinie refrattarie alle comuni terapie non invasive. Ne consegue l'approccio chirurgico di asportazione del coccige, detta coccigectomia. Approcci non invasivi al problema variano dall'assunzione di farmaci anti-infiammatori, miorilassanti, fisioterapia, infiltrazioni del coccige. Il Dottor Gagliardi effettua infiltrazioni eco-guidate.
Più di 100 abstract congressuali
Il Dottor Filippo Gagliardi ha partecipato con più di 100 abstract a congressi di rilevanza nazionale ed internazionale.
Numerose collaborazioni scientifiche
Il Dottor Filippo Gagliardi, nell’ambito della sua attività clinico-chirurgica e scientifica, ha collaborato con numerose strutture di prestigio nazionale e internazionale.
Numerose esperienza didattiche
Il Dottor Filippo Gagliardi ha all'attivo numerose esperienza didattiche in qualità di tutor, docente e membro della Faculty a congressi e corsi nazionali ed internazionali.
Protocolli di ricerca
Il Dottor Filippo Gagliardi ha partecipato e continua a partecipare attivamente a progetti interdisciplinari di ricerca clinica e pre-clinica sui tumori cerebrali
Visite ambulatoriali
Cerca l'ambulatorio più vicino a te e prenota un appuntamento per visite ambulatoriali col dottor Filippo Gagliardi.
Due tipologie di ricovero
Ricoveri in convenzione con il Sistema Sanitario Nazionale
I ricoveri in convenzione con il S.S.N. vengono effettuati presso l’Unità Operativa di Neurochirurgia (2° piano settore Iceberg), Ospedale San Raffaele, Via Olgettina, 60 -20132- Milano. L’indicazione al ricovero viene stabilita in occasione della valutazione neurochirurgica ambulatoriale. Il paziente viene contattato, una settimana prima del presunto ricovero, dal servizio di Segreteria Ricoveri del Reparto. In seguito, il paziente viene invitato a recarsi il mattino stesso presso l’accettazione centrale dell’ospedale con l’impegnativa di ricovero del medico curante, i documenti personali e tutta la documentazione clinica relativa al ricovero e ad eventuali pregressi problemi di salute. Dopo l'accettazione amministrativa il paziente si reca presso il Reparto di Neurochirurgia (2° piano, settore Iceberg). Qui viene eseguita l’accettazione medica ed infermieristica. Le dimissioni avvengono di norma entro le ore 12 del giorno stabilito, previa consegna della lettera di dimissione con una sintesi delle procedure diagnostico-terapeutiche eseguite, le terapie da proseguire presso il domicilio e gli eventuali successivi controlli.
Ricoveri in regime di Solvenza
I ricoveri in regime di Solvenza avvengono presso il Reparto Solventi, situato al 6° piano, settore Iceberg, Ospedale San Raffaele, Via Olgettina, 60 -20132- Milano. Il ricovero può essere effettuato in regime di solvenza pura o in regime di solvenza convenzionata con assicurazione sanitaria. Nel caso in cui l’assicurazione non sia convenzionata con l’ente o con il personale medico, il paziente, in accordo con l’assicurazione, potrà eseguire il ricovero con assicurazione indiretta. L’indicazione al ricovero viene stabilita in occasione di valutazione neurochirurgica ambulatoriale. In tale circostanza il paziente deve esplicitamente richiedere un ricovero in solvenza e viene, pertanto, formulato un preventivo. Previa accettazione del preventivo da parte del Paziente o dell’assicurazione, si procede alla programmazione del ricovero. Il giorno del ricovero il paziente deve recarsi presso l’accettazione solventi (piano terra, settore D). Deve portare con sé i documenti e la documentazione clinica relativa al ricovero. Dopo l'accettazione amministrativa, il Paziente viene successivamente ricoverato presso il reparto di solvenza. ![]()
Progetti di ricerca.
Il Dottor Filippo Gagliardi è attivamente impegnato nello sviluppo di progetti di ricerca clinica e pre-clinica nei seguenti settori:
Ricerca pre-clinica di base
- Ricerca di nuovi oncogeni e biomarcatori nel trattamento dei tumori cerebrali.
- Caratterizzazione molecolare delle cellule staminali derivate da tumori cerebrali.
- Sviluppo di protocolli innovativi di imaging dei tumori cerebrali e studi di radiogenomica.
Ricerca clinica
- Sviluppo di tecniche micro-chirurgiche innovative per il trattamento dei tumori cerebrali.
- Sviluppo di nuovi modelli di training in neurochirurgia.
- Collabora allo sviluppo di protocolli di sperimentazione di nuovi farmaci per il trattamento dei tumori del sistema nervoso.
- Cofondatore della biobanca di materiale biologico per lo studio delle patologie del sistema nervoso centrale del San Raffaele.

Dr. Filippo Gagliardi im Labor mit Dr. Rossella Galli, Group Leader der „Neural Stem Cell Biology Unit, Division of Regenerative Medicine, Stem Cells and Gene Therapy“ vom Krankenhaus San Raffaele, während ihrer Forschungsaktivität über Stammzellen. Dr. Gagliardi und Dr. Galli arbeiten weiterhin aktiv an mehreren präklinischen Forschungsprojekten über Tumoren des Nervensystems mit. ![]()
Neurofisiologia intraoperatoria
La neurofisiologia intraoperatoria è di fondamentale importanza durante interventi in aree ad elevato contenuto funzionale. Viene coinvolta, infatti, un'equipe di neurofisiologi che, con strumenti ad alta precisione, monitorano l’attività elettrica del cervello, del midollo spinale (potenziali evocati somato-sensitivi e motori) e dei nervi cranici durante la procedura. Così facendo si minimizza il rischio di danno accidentale a queste strutture.
Indicazioni
Le indicazioni per l'utilizzo di questa tecnologia sono le resezioni di lesioni:
- cerebrali in sede critica (area motoria, area del linguaggio),
- intramidollari (dentro il midollo spinale),
- dei nervi cranici (come ad esempio il neurinoma vestibolare)
- dei nervi periferici.
Anche in questo caso è un lavoro di equipe e non può prescindere dalla presenza all'interno della sala operatoria anche di un team di neurofisiologi esperti che dialogano costantemente con il chirurgo.
Gliomi
I gliomi sono tumori che originano dalla cellule che costituiscono la struttura di supporto dei neuroni; queste cellule sono gli astrociti, gli oligodendrociti e le cellule ependimali. Per la loro origine istologica, i gliomi sono definiti tumori neuroepiteliali. In quanto lesioni intrinseche al tessuto cerebrale, sono detti tumori intra-assiali. Coinvolgono principalmente la sostanza bianca cerebrale, ma spesso si estendono anche alla sostanza grigia (corteccia cerebrale e nuclei della base).
Epidemiologia
Nel contesto dei tumori primitivi del sistema nervoso centrale i gliomi sono relativamente frequenti, rappresentando più della metà dei casi (55%). Il picco di incidenza delle lesioni a basso grado di malignità cade tra i 20 e i 30 anni di età senza prevalenza di genere; rappresentano solo il 15% dei tumori gliali nel soggetto adulto. Per i tumori ad alto grado il picco di incidenza è compreso tra i 40 e i 60 anni di età senza prevalenza di genere; rappresentano solo l’85% dei tumori gliali nel soggetto adulto.
Patologia
I gliomi più comuni sono gli astrocitomi, tumori che originano dalle cellule della linea astrocitaria (astrociti). In ordine di frequenza decrescente, ci sono gli oligodendrogliomi, che originano dalle cellule oligodendrogliali (oligodendrociti) e, infine, gli ependimomi, che originano invece dalle cellule ependimali, rivestimento cellulare delle cavità ventricolari (ventricoli cerebrali). La morfologia e le caratteristiche genetiche di ciascun tipo di glioma sono peculiari del singolo sotto-tipo di tumore.
Gliomi circoscritti e gliomi diffusi
E' importante sottolineare una prima suddivisione morfologica in seno alla famiglia dei gliomi, basata sul comportamento più o meno infiltrativo nei confronti del tessuto cerebrale: gliomi circoscritti e gliomi diffusi. I gliomi circoscritti, sono un'entità patologica rara, includono l'astrocitoma pilocitico, lo xantoastrocitoma pleomorfo e l'astrocitoma sub-ependimale a cellule giganti; i gliomi diffusi includono invece l'astrocitoma fibrillare, l'astrocitoma protoplasmico e l'astrocitoma gemistocitico. Sfortunatamente, la maggior parte dei gliomi presenta caratteristiche di alta diffusione della patologia nella sostanza bianca (infiltrazione). A causa di questa caratteristica la loro exeresi radicale con la chirurgica diventa una pratica particolarmente complessa . In base alla composizione gli oligodendrogliomi possono essere ulteriormente classificati in oligodendrogliomi e oligoastrocitomi con le relative forme anaplastiche; gli ependimomi in ependimomi, ependimomi anaplastici e subependimomi. Ci sono inoltre neoplasie con caratteristiche miste (glio-neuronali), cioè costituite da componenti gliali e neurali, come i gangliogliomi, i gangliocitomi, e i neurocitomi. Attualmente sempre un maggiore peso sta acquisendo la definizione di alcune caratteristiche molecolari. Si tratta di:
- lo stato di metilazione del gene MGMT,
- la mutazione del gene IDH-1,
- IDH-2,
- ATRX,
- la perdita di eterozigoti 1p19q
- il gene p53, la mutazione di un gene che sopprime il tumore
Altro indicatore prognostico fondamentale è l'indice mitotico (ki67). In sintesi questi sono indicatori ormai validati della prognosi della malattia. in particolare l'assenza di metilazione del gene MGMT, così come l'assenza di mutazione dei geni IDH-1, IDH2, (definita IDH wild-type), l'eterozigosi 1p19q, insieme alla mutazione del gene p53 e l'elevato indice mitotico (ki67) sono predittivi di una prognosi più severa, per cui in alcune circostanze i pazienti devono essere trattati con approcci specifici.
Gradi di aggressività biologica
Per graduare l'aggressività biologica "grading" dei tumori del SNC nel tempo sono stati suggeriti diversi sistemi. Dal 1993 il sistema di classificazione a 4 gradi proposto dalla World Health Organization (WHO) è risultato il più largamente accettato e diffuso. Si basa su quattro caratteristiche istologiche che ne conferiscono crescente aggressività biologica: atipia nucleare (pleomorfismo), presenza di mitosi, proliferazione endoteliale (neoangiogenesi), necrosi. Nella letteratura si usa la dicitura "glioma a basso grado" (low-grade glioma, ovvero l'acronimo LGG in inglese) ad indicare tumori gliali di grado WHO I e II; mentre si usa "glioma ad alto grado" (high-grade glioma, HGG) ad indicare tumori della glia di grado III e IV.
Classificazione
I gliomi possono essere classificati anche in base alla loro sede. Spesso la sede determina anche alcune delle loro caratteristiche di grading e istologiche. Entità più frequenti sono i gliomi lobari che prendono il nome dal lobo cerebrale coinvolto (e.g. glioma frontale, temporale, parietale e occipitale). I gliomi talamici sono gliomi localizzati a livello del talamo, un nucleo cerebrale profondo che veicola informazioni motorie e sensitive, importante punto di relè degli stimoli neurologici. I gliomi diffondono seguendo le fibre della sostanza bianca cerebrale. La struttura più eloquente in questo ambito è il corpo calloso, ovvero la struttura funzionale che connette i due emisferi cerebrali.
Gliomi a farfalla
I gliomi che crescono da un emisfero cerebrale all'emisfero controlaterale, passando attraverso il corpo calloso, assumono una forma tipica che ricorda una farfalla, vengono pertanto definiti gliomi "a farfalla". I gliomi a farfalla sono di per loro non chirurgici poiché la resezione del corpo calloso è gravata da una morbidità cognitiva eticamente inaccettabile.
Gliomi del tronco e delle vie ottiche
Il tronco dell'encefalo può essere sede di gliomi, soprattuto in giovane età. I gliomi diffusi del tronco sono generalmente di basso grado di malignità (WHO grade II) tra questi il più frequente è il glioma diffuso del ponte. Estensione nosologica dei gliomi del tronco sono i gliomi della linea mediana. Anche essi spesso di basso grado (la variante "diffusa" è la più rappresentata) e sono caratterizzati dalla presenza della mutazione del gene H3K27, responsabile di variazioni nei meccanismi di traduzione del DNA. La mutazione è considerata patognomonica dei gliomi diffusi della linea mediana. Un'altra entità a sé stante è il glioma delle vie ottiche, ovvero un glioma che origina dal nervo ottico. E' generalmente un glioma a basso grado di malignità (astrocitoma pilocitico); tendono a crescere lungo il decorso dei nervi ottici, del chiasma ed dei tratti ottici. Sono tumori radiosensibili, pertanto indicati alla radioterapia. L'insorgenza, vista la sede, si associa per lo più a disturbi della vista.
GLIOMI A BASSO GRADO
GLIOMI AD ALTO GRADO
Gliomi a basso grado
I gliomi a basso grado sono tumori cerebrali primitivi a basso grado di malignità (aggressività biologica). Questo aspetto riflette un comportamento tendenzialmente indolente ed una crescita lenta, anche se con alcune eccezioni. Il picco di incidenza cade tra i 20 e i 30 anni di età senza prevalenza di genere, rappresentando solo il 15% dei tumori nel soggetto adulto. I gliomi di basso grado comprendono tumori circoscritti, ovvero ben delimitati, anche detti astrocitomi circoscritti, oligodendrogliomi, e tumori con margini meno definiti, classificati come astrocitomi diffusi o di grado II.
Patologia
I tumori circoscritti comprendono l'astrocitoma pilocitico (con la variante pilomixoide), l'astrocitoma sub-ependimale a cellule giganti e lo xantoastrocitoma pleomorfo. Accanto alla famiglia degli astrocitomi c'è quella degli ependimomi e degli oligodendrogliomi. L'oligodendroglioma è associato ad una prognosi migliore ed è spesso associato ad un'alterazione genetica favorevole detta codelezione 1p19q, che va necessariamente ricercata nell'esame istologico. I gliomi diffusi includono invece l'astrocitoma fibrillare, l'astrocitoma protoplasmico e l'astrocitoma gemistocitico. Ci sono anche tumori a componente mista, astrocitaria e oligodendrogliale, detti oligoastrocitomi. Gli aspetti caratteristici da ricercare nei gliomi a basso grado di malignità sono:
- la presenza/assenza della codelezione 1p19q,
- l'indice mitotico (MIB o Ki67),
- la presenza/assenza di mutazione del gene IDH
- la definizione della componente astrocitaria e oligodendrogliale
Questi aspetti hanno un valore terapeutico e prognostico molto importante.
Clinica
I pazienti affetti da gliomi a basso grado possono presentare:
- crisi epilettiche
- deficit neurologici focali (difetti di funzioni neurologiche specifiche)
- cefalea
- alterazioni cognitive
L'età media alla diagnosi è di circa 45 anni (pazienti giovani). In particolare, la maggior parte dei pazienti con astrocitomi diffusi sono giovani adulti (terza e quarta decade di età). L'esordio é caratterizzato solitamente da attacchi epilettici.
Diagnosi
La diagnosi viene effettuata con tecniche di imaging tradizionale, TC e RM, e tecniche di neuroimaging avanzato ovvero RM ad alto campo magnetico (3 Tesla). Cosí facendo si aumenta la precisione diagnostica. Si indaga anche la sede delle funzioni superiori e dei fasci di sostanza bianca che collegano le aree corticali ai nuclei cerebrali più profondi. La spettroscopia è un esame non invasivo. Consente di definire la composizione chimica del tessuto malato, aumentando il potere diagnostico dell'imaging preliminare.
- Alla TC gli astrocitomi diffusi di grado II appaiono come lesioni molto simili, per caratteristiche radiologiche, al tessuto sano, ovvero a bassa attenuazione ovvero isointense (hanno cioè un segnale molto simile al parenchima cerebrale).
- Alla RM (la metodica di preferenza) la presa di contrasto di questi tumori di solito è assente (criterio distintivo di queste lesioni, fatta eccezione per l'astrocitoma pilocitico). Enhancement focalmente intenso può indicare aree di aumentata anaplasia.
Terapia
I gliomi di basso grado sono tumori relativamente rari, con una istologia benigna, curabili e in molti casi anche guaribili con la resezione chirurgica. Nei casi in cui l'escissione chirurgica dovesse essere incompleta, per vicinanza a struttura critiche, il tumore può rimanere comunque indolente per anni. Viene trattato con successo con la radioterapia o, laddove indicata, anche con la chemioterapia. Nei casi in cui il trattamento locale fallisca, i tumori tendono a recidivare localmente, spesso ai margini della cavità di resezione chirurgica. In questi casi, se l'opzione della radioterapia non fosse più percorribile perché già utilizzata, trova indicazione un percorso di terapia oncologica. Si procede con trattamento sistemico con chemioterapia, sulla cui indicazione non c'è ancora unanime consenso. Molti sono i farmaci che si possono utilizzare: farmaci tradizionali in combinazione (il così detto protocollo PCV dal nome dei tre farmaci principali utilizzati) e farmaci di nuova generazione come il Temodal, attualmente riservato per le recidive. Caratteristiche per una prognosi favorevole includono la giovane età alla diagnosi, la grandezza del tumore inferiore a 5 cm e, se possibile, la resezione estesa della neoplasia. Nonostante il loro corso relativamente indolente, parte di questi astrocitomi può evolvere verso lesioni più aggressive. Questo aspetto va considerato attentamente nella gestione della patologia.
Chirurgia
Il ruolo della resezione “completa” è argomento di dibattito nei contesti specialistici. I risultati di alcuni studi evidenziano che la massima resezione del tumore fornisce i migliori risultati. Tuttavia la “resezione completa” spesso finisce col concentrarsi su un ben selezionato gruppo di pazienti, con tumori piccoli, che non coinvolgono strutture critiche del cervello. Tutto sommato, un approccio pragmatico accettabile per la generalità dei casi risulta quello di una escissione di quanto più è possibile del tessuto neoplastico (maximal safe resection), evitando di causare deficit neurologici significativi. In tutti i casi di tumori grandi e sintomatici, laddove percorribile, la chirurgia è la terapia di scelta.
Wait and see
Nel caso di tumori piccoli ed asintomatici il wait and see (atteggiamento di osservazione) può essere un'opzione. Studi recenti hanno dimostrato che la resezione radicale è associata ad un vantaggio in termini di sopravvivenza. Nell'astrocitoma pilocitico, in particolare, la chirurgia è la terapia di scelta. Se l'asportazione è stata radicale non é necessaria radioterapia successiva, .
Radioterapia
La radioterapia è indicata in un selezionato numero di pazienti, che rientrano in criteri prognostici negativi, ed è effettuata dopo la chirurgia (radioterapia adiuvante). Questo avviene anche se, allo stato attuale, non c'è unanime il convincimento che la radioterapia, subito dopo la diagnosi, migliori la sopravvivenza globale del paziente. Di solito è erogata in 30 frazioni, 30 giorni di trattamento (5 giorni a settimana per 6 settimane). Le applicazioni durano pochi minuti e non sono dolorose. Può essere utile accompagnare il periodo di radioterapia con la somministrazione di cortisone. Cosí si controlla l'effetto irritativo della radiazione sul tessuto cerebrale.
Chemioterapia
La chemioterapia può essere associata alla radioterapia in casi selezionati. Il ruolo della chemioterapia adiuvante per i pazienti con astrocitomi di basso grado è ancora oggetto di studio. Attualmente è riservata ai tumori associati a fattori prognostici sfavorevoli. Il protocollo di scelta è detto PCV, dai farmaci che lo compongono, e si somministra in 6 cicli di trattamento. Si associa al trattamento radioterapico.
Prognosi
La prognosi di questi tumori di solito è buona con buoni tassi di sopravvivenza a 5 e 10 anni. In particolare il tempo medio libero da malattia per i gradi I e II è di 7-15 anni con un maggior rischio di evoluzione anaplastica nei tumori gemistocitici. Per la tendenza a recidivare sono patologie da tenere osservate per anni, anche dopo il loro trattamento. Recenti lavori hanno evidenziato quali fattori critici per la prognosi:
- l'età
- la dimensione del tumore
- il grado di resezione
- la componente astrocitaria nell'istologia
- l'indice mitotico
- la presenza o assenza di codelezione 1p19q
- l'assenza di mutazione di IDH
E' fondamentale che i pazienti con gliomi a basso grado vengano trattati in centri specializzati. Solo con tutte le tecnologie diagnostiche e terapeutiche disponibili si potrá ottenere il trattamento migliore. Al San Raffale queste patologie sono curate con un approccio multidisciplinare all'avanguardia. Il Dr. Filippo Gagliardi si occupa della chirurgia della patologia gliale ed è membro responsabile della Disease Unit di Neuroncologia dell'ospedale, nonché referente per la Neurochirurgia.
Gliomi ad alto grado
I gliomi ad alto grado sono tumori primitivi cerebrali ad alto grado di malignità e aggressività biologica. Questo aspetto riflette un comportamento tendenzialmente aggressivo del tumore ed una crescita rapida, anche se con alcune eccezioni. Il picco di incidenza cade tra i 40 e i 60 anni di età senza prevalenza di genere; rappresentano l'85% dei tumori gliali nel soggetto adulto e raggiungono una frequenza di oltre il 90% dei casi di tumore primitivo cerebrale dopo i 70 anni di età.
Patologia
I gliomi ad alto grado comprendono l'astrocitoma anaplastico, il glioblastoma, con le loro varianti, il gliosarcoma, glioblastoma giganto-cellulare, e la gliomatosi cerebrale. In particolare il tumore ad alto grado più diffuso per frequenza è il glioblastoma. La gliomatosi cerebrale è una condizione in cui vi è una disseminazione di cellule tumorali nelle vie liquorali (ventricoli cerebrali, spazi subaracnoidei) con secondaria diffusione della malattia in tutto il sistema nervoso centrale (nevrasse), in particolare sulla superficie degli emisferi cerebrali, sui nervi cranici e sulla superficie del cervelletto. Rappresenta uno stadio avanzato di malattia e, una volta diagnosticata, è indirizzata alle terapie adiuvanti. Questa condizione ha purtroppo un'elevata mortalità; quando indicato, viene trattata con terapia sistemica (chemioterapia), RT panencefalica (su tutto l'encefalo) e, nel caso di sviluppo di idrocefalo, con intervento di derivazione ventricolo-peritoneale. Altre forme diffuse sono i gliomi multifocali; in questi casi il tumore presenta diversi noduli localizzati su entrambi gli emisferi, anche in questo caso la terapia di elezione è la chemioterapia con temozolomide e la radioterapia.
Gliomi ad alto grado
Sono anch'essi tumori relativamente rari, con una istologia maligna, caratterizzati in particolare dalla presenza di atipie nucleari, aumentato numero di mitosi, presenza di neoangiogenesi e necrosi. La presenza di neoangiogenesi consente di distinguere l'astrocitoma anaplastico (grado III) dagli astrocitomi di basso grado. La presenza invece di necrosi è caratteristica dei tumori di grado IV, glioblastoma. Il gliosarcoma ha prevalenti componenti mesenchimali o connettivali. Indici di prognosi peggiore includono l'età più avanzata, una scarsa condizione fisica generale, un danno neurologico significativo. La necrosi dei glioblastomi ha caratteristiche morfologiche tipiche e viene definita per la sua conformazione, necrosi a palizzata (palisading necrosis). Sono curabili con approcci terapeutici multimodali, che includono la chirurgia, la radioterapia e la chemioterapia. Gli aspetti caratteristici da ricercare anche nei gliomi ad alto grado di malignità sono:
- presenza/assenza della codelezione 1p19q
- indice mitotico (MIB o Ki67)
- presenza/assenza di mutazione del gene IDH1, 2 e ATRX
- mutazione inattivante della proteina p53
- definizione della componente astrocitaria e oligodendrogliale
Questi aspetti hanno un valore terapeutico e prognostico molto importante. In particolare lo stato di metilazione del gene MGMT è predittivo della sensibilità della malattia al trattamento tradizionale con Temozolomide, pertanto fondamentale per la scelta terapeutica. Il recettore per l'EGF, epidermal growth factor, EGFR, è un indice prognostico importante nei gliomi ad alto grado. La iper-espressione nella sua variante III, vIIIEGFR, è indice di aggressività biologica del tumore. Questo aspetto va considerato nella pianificazione terapeutica.
Clinica
I pazienti con gliomi ad alto grado possono presentare crisi epilettiche (generalizzate o parziali), deficit neurologici focali, cefalea, modificazioni della personalità e segni di ipertensione intracranica (cefalea, vomito e disturbi visivi).
Diagnosi
La diagnosi viene effettuata con tecniche di imaging tradizionale, TC e RM, e tecniche di neuroimaging avanzato ovvero RM ad alto campo magnetico (3 Tesla). Anche in questo caso, la spettroscopia consente di definire la composizione chimica del tessuto malato, aumentando il potere diagnostico dell'imaging preliminare.
- La RM rivela generalmente la presenza di una lesione con aumento di segnale di contrasto (enhancement), anche se vi sono casi in cui tale enhancement non è evidente. Spesso la presa di contrasto è marginale, detta anche presa di contrasto ad anello e rappresenta l'alterazione della membrana tra cervello e sangue, detta barriera amato-encefalica. La presa di contrasto nelle patologie gliali, fatta eccezione per gli astrocitomi pilocitici, è quasi sempre espressione di patologia ad alto grado.
Trattamento
L'approccio terapeutico ai gliomi ad alto grado è multimodale e include chirurgia, radioterapia e chemioterapia. La chirurgia, laddove percorribile, è il passo fondamentale e va eseguita in centri ad alta specializzazione come il San Raffaele. Alla chirurgia va necessariamente affiancata la radioterapia e la chemioterapia come terapia adiuvante (Temodal). E' ormai riconosciuto a livello mondiale lo schema Stupp che prevede una prima fase di chemioterapia concomitante alla radioterapia ed una seconda fase di chemioterapia adiuvante di mantenimento. In seconda linea si utilizza un farmaco biologico che inibisce la formazione di nuovi vasi (neoangiogenesi), il farmaco anti-angiogenetico Bevacizumab, per ridurre il nutrimento al tumore. Anche per i gliomi ad alto grado lo stato di metilazione del gene MGMT, la mutazione del gene IDH-1, IDH-2, ATRX, la perdita di eterozigoti 1p19q e la mutazione di un gene che sopprime il tumore, il p53. Altri indicatori fondamentali sono l'indice mitotico (ki67), indicatori ormai validati della prognosi della malattia. In generale, l'esito terapeutico è migliore dopo resezione chirurgica “completa”, ma non è chiaro se tale miglior risultato è da associare all'intervento in sé o allo scenario clinico complessivo che ha permesso tale resezione.
Chirurgia
Il trattamento standard prevede come primo passo la massima asportazione possibile, cercando di limitare la morbidità e di non indurre un deficit funzionale al paziente "maximal safe resection". E' necessario che al chirurgia venga effettuata in un centro ad alta specializzazione come il San Raffaele. Questo garantisce al Paziente il massimo della tecnologia disponibile e l'esperienza di un'equipe con training specifico per affrontare la malattia. Si è visto che nei centri ad alto flusso questo tipo di chirurgia è gravata da minori complicanze. Le nuove frontiere in questo tipo di chirurgia sono la neuronavigazione, l'ecografia intra-operatoria, la fluorescenza intra-operatoria, la microscopia intra-operatoria, la chirurgia a paziente sveglio, il monitoraggio neurofisiologico intra-operatorio.
Radioterapia e chemioterapia
Sono uno standard nel trattamento (protocollo Stupp) in quanto hanno dimostrato di prolungare in modo significativo la durata della sopravvivenza. Lo schema Stupp prevede due fasi. La prima di chemioterapia concomitante alla radioterapia. La seconda di chemioterapia adiuvante di mantenimento (5 gg di trattamento ogni 28 giorni per 6 cicli di trattamento). In seconda linea si utilizza un farmaco biologico che inibisce la formazione di nuovi vasi (neoangiogenesi), farmaco anti-angiogenetico o Bevacizumab. Così si riduce il nutrimento al tumore. La radioterapia è erogata in 30 frazioni, 30 giorni di trattamento (5 giorni a settimana per 6 settimane). Le applicazioni durano pochi minuti e non sono dolorose. Può essere utile accompagnare il periodo di radioterapia con la somministrazione di cortisone per controllare l'effetto irritativo della radiazione sul tessuto cerebrale.
Approccio multimodale
La strategia terapeutica deve sempre prevedere un intervento collegiale e solidale (Disease Unit) tra neurochirurgo, radioterapista, patologo, neuroncologo e neuroradiologo. L'approccio terapeutico va necessariamente individualizzato, ovvero ritagliato sul singolo paziente, seguendone esigenze cliniche ed oncologiche. In particolare per i pazienti anziani (>75 anni) sono riservati protocolli dedicati con cicli di radioterapia ipofrazionati (riduzione della dose erogata e delle frazioni di trattamento).
Lesioni non operabili
In alcuni casi il tumore può non essere aggredibile chirurgicamente per sede o estensione della malattia. In questi casi è fondamentale avere una diagnosi istologica, per lo più attraverso una biopsia stereotassica, per poterne valutare il profilo molecolare e il grado di aggressività biologica. Una volta ottenuta la diagnosi istologica, il caso viene discusso in Disease Unit (riunione multidisciplinare neuroncologica) e valutata la strategia terapeutica migliore, che di solito coinvolge radioterapia, chemioterapia o eventuali nuovi approcci terapeutici sperimentali. Al San Raffaele il Dr. Gagliardi collabora in diversi progetti di sperimentazione clinica di nuovi farmaci per il glioblastoma.
Prognosi
La mediana di sopravvivenza mostra un intervallo variabile che va da 24 mesi a più di 36 mesi. L'ampiezza di questo campo di variazione riflette i criteri di selezione dei pazienti. In particolare la storia naturale dei gradi III è di 2-3 anni, mentre nel glioblastoma è di 18 mesi. In caso di recidiva (dopo la radioterapia) il ricorso alla chemioterapia non pone dubbi: sia i regimi basati sulla nitrosouree, sia la Temozolomide hanno mostrato efficacia. Nelle recidive va sempre valutata anche l'opzione chirurgica. La chirurgica va attentamente considerata in base alla sede, alla diffusione di malattia e al tempo intercorso dalla chirurgia precedente. La risposta alla Temozolomide è del 35% per pazienti che non hanno ricevuto chemioterapia in precedenza e del 20% per pazienti che sono al successivo regime di chemioterapia (in particolare dopo nitrosouree). In seconda linea si utilizza un farmaco biologico che inibisce la formazione di nuovi vasi (neoangiogenesi), farmaco anti-angiogenetico (Bevacizumab), con infusioni ogni 2 settimane per 4 cicli totali. Recentemente è stato introdotto anche un anticorpo monoclonale. Questo inibisce gli enzimi che favoriscono la proliferazione delle cellule tumorali (Regorafenib). In ogni caso si tratta di malattie ad elevata aggressività clinica e biologica. Per questo è necessaria la tempestività della diagnosi e della terapia.
Patologia gliale
Recenti lavori hanno evidenziato come fattori critici per la prognosi, l'età, la dimensione del tumore, il grado di resezione, la componente astrocitaria nell'istologia, l'indice mitotico, la presenza di marcatori molecolari specifici sono critici per la prognosi. E' fondamentale che i pazienti con gliomi ad alto grado vengano trattati in centri specializzati. Qui ci sono tutte le tecnologie diagnostiche e terapeutiche disponibili per ottenere il trattamento migliore. Al San Raffale queste patologie sono curate con un approccio multidisciplinare all'avanguardia. Il Dr. Filippo Gagliardi si occupa della chirurgia della patologia gliale ed è membro responsabile della Disease Unit di Neuroncologia dell'ospedale, nonché referente per la Neurochirurgia. Attualmente la ricerca sta facendo enormi passi avanti nella comprensione dei meccanismi biologici che sottendono l'aggressività clinica di queste patologie. Il Dr. Gagliardi partecipa attivamente alla ricerca pre-clinica in questo ambito e a sperimentazione cliniche multicentriche di nuovi farmaci e protocolli terapeutici. Di seguito un immagine intra-operatoria di una ecografia. Ecco il prima e il dopo la resezione di un tumore gliale ad alto grado di malignità. 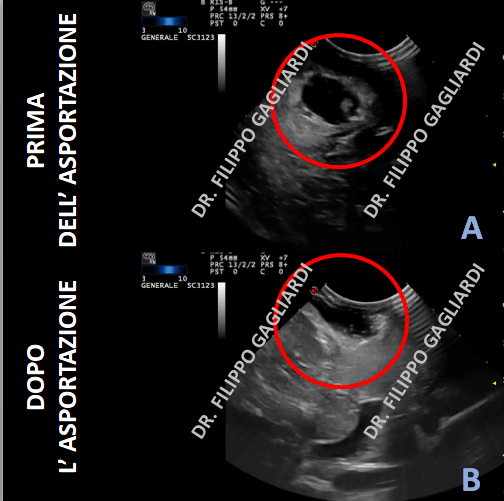 Resezione gliomi ad alto grado
Resezione gliomi ad alto grado
Meningiomi
Definizione
I meningiomi sono tumori cerebrali estrinseci o extra-assiali, ovvero che crescono al di fuori dal tessuto cerebrale. Essi originano dalle cellule delle meningi (dura madre ed aracnoide), involucri di rivestimento del tessuto nervoso. Sono lesioni che crescono al di fuori del cervello e tendono, crescendo, a comprimere la corteccia cerebrale sottostante, a volte infiltrandola, ovvero perdendo il margine di demarcazione. Il meningioma può associarsi ad edema cerebrale, per lo più dovuto alla compressione delle vene corticali. Il nome di questa neoplasia, solitamente benigna, è stato coniato da Harvey Cushing che ne ha anche descritto gli aspetti più importanti.
Epidemiologia
Si ritiene che i meningiomi rappresentino il 30% di tutti i tumori cerebrali. Il 90% dei meningiomi sono intra-cranici e di questi il 90% originano al di sopra del tentorio (un sepimento che divide lo spazio intra-cranico). Il restante 10% invece coinvolge lo spazio sotto-tentoriale o fossa cranica posteriore, dove ha sede il, cervelletto e il tronco dell'encefalo. Non sono stati accertati fattori di rischio certi per l'insorgenza dei meningiomi. Sembra tuttavia che l'esposizione infantile alle radiazioni possa contribuire all'insorgere del tumore. E' caratteristicamente più frequente nei soggetti di sesso femminile e sembra che queste patologie siano sensibili agli ormoni estrogeni e progesterone. Solo il 10% dei meningiomi cresce a livello della dura madre che riveste il midollo spinale. L’incidenza della patologia aumenta progressivamente con l’età, con un picco di incidenza in corrispondenza della sesta decade di vita. Sono due volte più frequenti nel sesso femminile. Nei meningiomi spinali il rapporto femmine/maschi raggiunge addirittura i 9 casi a 1. Nel 80-85% dei casi i meningiomi sono benigni, rare sono le lesioni atipiche (15-18%) e ancora più rare le lesioni anaplastiche (3%). La neurofibromatosi (sia la NF-1 che la NF-2), malattia ereditaria relativamente rara, è associata in modo significativo con l'insorgere dei meningiomi. Aberrazione cromosomica di frequente riscontro nei meningiomi è la perdita di una copia del cromosoma 22; nei meningiomi insorti nei maschi è frequente anche la perdita del cromosoma Y.
Fattori di rischio
Nonostante i numerosi studi in materia pochi sono i fattori di rischio individuati con certezza nello sviluppo della malattia; tra questi l’esposizione alle radiazioni ionizzanti, sindromi genetiche come la neurofibromatosi di tipo 2 e al schwannomatosi, fattori ormonali (in particolare legati allo squilibrio dell’asse degli ormoni sessuali), l’utilizzo di farmaci anti-androgeni ad alte dosi, l’obesità, il tumore della mammella, pregressi traumi cranici. Le radiazioni ionizzanti a scopo terapeutico (radioterapia per tumori cerebrali, per tumori testa-collo e irradiazione profilattica del nevrasse nelle leucemie) sembrano essere implicate nello sviluppo di tumori sporadici. La latenza di sviluppo della malattia dopo l’esposizione ai raggi si attesta intorno ai 20 anni. La predisposizione genetica è stata dimostrata nella neurofibromatosi di tipo 2, la schwannomatosi e la MEN1. Fattori ormonali, in particolare legati agli estrogeni e al progesterone, l’utilizzo di farmaci anti-androgeni ad alte dosi sono stati dimostrati aumentare il rischio di sviluppare la malattia.
Origine
I meningiomi originano dalle cellule della meninge cerebrale e in particolare dallo strato della aracnoide. Questa membrana è situata tra la dura madre, localizzata esternamente, e la pia madre, localizzata internamente a stretto contatto con la corteccia cerebrale. L'aracnoide avvolge il cervello e il midollo spinale, si trova inoltre all'interno dei ventricoli cerebrali, cavità naturali presenti all'interno del cervello che contengono un liquido trasparente detto liquido cefalo-rachidiano; di conseguenza, tutte queste possono essere interessate dalla crescita di meningiomi.
Anatomia patologica
Il meningioma è solitamente una massa con una base di impianto sulla dura madre e un margine sul piano durale che viene definito coda durale (dural tail). Il colore varia dal giallo al grigio-rosato; la consistenza può essere sia soffice, sia elastica che molto dura, questo fattore influenza in modo sostanziale la resezione chirurgica. Anche la vascolarizzazione (e di conseguenza il rischio di sanguinamento intra-operatorio) può essere estremamente variabile. Nel contesto della lesione possono spesso trovarsi aree ad alta concentrazione di calcio, calcificazioni.
Meningiomi
La maggior parte dei meningiomi cresce in prossimità delle ossa della volta cranica (meningiomi della convessità), provocando a lungo termine una iper-proliferazione ossea (detta iperostosi reattiva) o una vera e propria invasione e rimodellamento dell'osso da parte delle cellule del tumore (scalloping osseo). Tumori che originano dalla base del cranio (meningiomi della base) sono localizzati in profondità nel cranio, a stretto contatto con nervi e vasi sanguigni maggiori come l'arteria carotide, l'arteria basilare e i nervi cranici. All'esame microscopico il meningioma presenta cellule connettivali disposte a formare delle spirali attorno ad un centro di materiale chiaro (ialino) con la presenza di eventuali piccole calcificazioni (dette corpi psammomatosi). Esistono diversi tipi istologici di meningiomi. La maggioranza di questi sono ascrivibili al grado I secondo la classificazione WHO. Si tratta, quindi, di patologie tendenzialmente benigne. Varianti sono il meningioma sinciziale, fibroso, psammomatoso, melanocitico, angioplastico e xantomatoso.
Meningiomi maligni
Anche se più rare esistono forme di meningiomi biologicamente più aggressive (meningiomi atipici, grado II) fino a vere e proprie forme di meningiomi maligni, meningiomi anaplastici (grado III) e sarcomi (grado IV), segnati da una storia naturale purtroppo molto diversa. In particolare il grading dei meningiomi correla con la prognosi clinica/oncologica e l’efficacia delle terapie. I gradi 2 e 3 hanno maggiore tendenza alla recidiva locale ed una sopravvivenza tendenzialmente più limitata. Tra i marcatori molecolari ad oggi identificati come più rilevanti per la prognosi dei pazienti ci sono le alterazioni del gene TERT, la delezione CDKN2A/B e la perdita di H3K27me3. In presenza di questi marcatori la patologia presenta una tendenza ad una maggiore aggressività biologica.
Classificazione
I meningiomi possono essere classificati in base alla sede di origine. Due sono i gruppi principali:
- meningiomi della convessità
- meningiomi della base cranica
I primi vengono ulteriormente divisi in base alla localizzazione lobare in frontali, parietali, temporali e occipitali. Gli altri vengono invece suddivisi in meningiomi della fossa cranica anteriore (meningioma della clinoide, meningioma del tuberculum sellae, meningioma del planum, meningioma della doccia olfattoria, meningiomi della sella, meningiomi del seno cavernoso), meningiomi della fossa cranica media (meningiomi sfeno-orbitari, meningiomi della rocca petrosa) e meningiomi della fossa cranica posteriore (meningiomi della rocca petrosa, meningiomi clivali, petro-clivali, sfeno-petro-clivali, meningiomi dell'angolo ponto-cerebellare, del forame magno). Entità a parte sono i meningiomi dei sepimenti durali: meningiomi della falce, parasagittali e del tentorio. In particolare i meningiomi della convessità sono generalmente più semplici da trattare. Perlopiù sono destinati ad una terapia chirurgica. Spesso i meningiomi della convessità possono presentare delle calcificazioni al loro interno (meningioma calcifico). Le calcificazioni sono di solito manifestazione di lenta crescita. Meningiomi calcifici della convessità, sotto il centimetro di dimensione massima, sono passibili di osservazione clinico-radiologica. Si interviene nel caso di crescita.
Maximal safe resection
I meningiomi della base cranica sono molto più complessi da gestire, a causa della profondità della loro localizzazione e della vicinanza con strutture neuro-vascolari critiche. Il trattamento ad oggi è primariamente mini-invasivo radiochirurgico, quando possibile. Nei casi in cui la radiochirurgia non sia percorribile, il trattamento è chirurgico con la finalità di maximal safe resection, togliere quanto più tumore possibile senza sacrificare strutture critiche. La chirurgia viene generalmente fatta seguire dal trattamento radiante, sia esso radiochirurgia o radioterapia convenzionale. Un discorso a parte è rappresentato dai meningiomi parasagittali. Crescono a cavallo del seno sagittale superiore, una struttura venosa. L'exeresi radicale non è quasi mai possibile, spesso si giovano di trattamenti combinati di chirurgia e radiochirurgia adiuvante. I meningiomi sfeno-orbitari spesso coinvolgono anche l'osso generando una iperostosi. crescono come una placca e vengono detti meningiomi en-plaque o meningiomi a placca. Come per i gliomi un'entità particolare è rappresentata dai meningiomi della guaina del nervo ottico, ovvero il rivestimento dei nervi ottici. Crescono letteralmente abbracciando il nervo e ne condizionano una sofferenza, che determina una perdita progressiva della vista. Ottimi risultati sono stati ottenuti nel loro trattamento con l'utilizzo della radiochirurgia frazionata. Essa si è dimostrata efficace nel controllare il tumore e nel preservare la vista del paziente.
Meningiomatosi
In rari casi si osserva la presenza contemporanea di più meningiomi; questa condizione viene definita meningiomatosi. Essa può essere correlata alla presenza di patologie genetiche, tipicamente la neurofibromatosi tipo I o tipo II o all'esposizione a fattori ambientali predisponenti come le radiazioni ionizzanti.
Clinica
Il meningioma si presenta come una massa intracranica in lenta crescita "espansione". Pertanto sintomi o segni clinici possono insorgere mesi o addirittura anni prima della diagnosi (insorgenza clinica tardiva). I segni dell'ipertensione endocranica sono i più frequenti; le crisi epilettiche (generalizzate o parziali), deficit neurologici focali, cefalea, modificazioni della personalità e segni di ipertensione intracranica. I deficit neurologici focali variano a seconda della sede di insorgenza. Alcuni esempi sono difetti di forza, (emiparesi, emiplegia, emisindrome), disturbi della sensibilità, disturbi della vista (deficit di campo visivo, papilla da stasi, amaurosi, calo del visus), disturbi del linguaggio (afasia, disfasia, disartria), fino a disturbi delle funzioni cognitive più complesse. I meningiomi possono essere classificati anche in base alla sede anatomica di origine. Le sedi più comuni sono: la falce cerebrale (25%), la convessità (20%), la grande ala dell'osso sfenoide (20%), la doccia olfattoria (10%), la regione sovra-sellare (10%), la fossa cranica posteriore (10%). Altre sedi possibili sono la regione parasagittale, il clivus, il forame magno, i ventricoli cerebrali e il midollo spinale. I meningiomi della base cranica, più rari, vengono anch'essi classificati in base alla sede di origine. Per citarne alcuni, vi sono i meningiomi del planum, della clinoide, del tuberculum sellae, della doccia olfattoria, del clivus, della giunzione petro-clivale, della giunzione cranio-cervicale, della rocca petrosa, della fossa cranica media.
Diagnosi
- La diagnosi di meningioma è possibile già alla TC. Qui si presenta come una massa extra-cerebrale a presa di contrasto omogenea e, a volte, con una o più aree calcifiche nel suo contesto.
- La RM con mezzo di contrasto è l'esame diagnostico migliore. Utile per definire i rapporti del tumore con le strutture circostanti (vasi, nervi, parenchima cerebrale, osso). Entrambi le modalità diagnostiche possono evidenziare la presenza di edema peri-lesionale e di eventuale idrocefalo.
Trattamento
In generale, l'esito terapeutico è migliore dopo resezione chirurgica “completa”. L'approccio terapeutico in ogni caso deve essere necessariamente multimodale.
Chirurgia
Il trattamento chirurgico è il trattamento di scelta, quando possibile. Trattandosi di un tumore benigno nella grande maggioranza dei casi, la resezione completa è auspicabile sebbene non sempre possibile, a causa dei possibili rapporti del tumore con vasi sanguigni (venosi o arteriosi), nervi o tessuto cerebrale (maximal safe resection). L'esempio classico è rappresentato dai meningiomi parasagittali, che possono infiltrare e ostruire il seno sagittale superiore; in questo caso la parte di tumore all'interno della struttura venosa non piò essere rimossa per l'elevato rischio di morbidità e deve essere necessariamente lasciata in sede ed eventualmente trattata con terapie adiuvanti.
Radiochirurgia
Un'alternativa alla chirurgia è rappresentata dalla radiochirurgia stereotassica, per il trattamento di residui post-operatori, recidive lesionali o di piccole lesioni altrimenti difficilmente accessibili con la chirurgia. La radiochirurgia é la tecnica di elezione nei meningiomi piccoli (sotto i 3 cm di diametro massimo) della base cranica. Nei meningiomi della convessità, invece, viene indicata solo per lesioni piccole in pazienti non eleggibili alla chirurgia a causa di comorbidità. La radiochirurgia stereotassica con Gamma Knife è una frontiera relativamente recente. Consente di trattare queste patologie senza dover aprire il cranio del paziente.
Radioterapia
In caso di meningiomi plurirecidivi o biologicamente aggressivi la radioterapia convenzionale può essere considerata tra le opzioni terapeutiche. La radioterapia (dose 60 Gy) è erogata in 30 frazioni, 30 giorni di trattamento (5 giorni a settimana per 6 settimane). Le applicazioni durano pochi minuti e non sono dolorose. Può essere utile accompagnare il periodo di radioterapia con la somministrazione di cortisone per controllare l'effetto irritativo della radiazione sul tessuto cerebrale.
Chemioterapia
Ad oggi non c'è ancora consenso unanime sull'utilizzo della terapia sistemica in presenza di meningiomi. Essa è riservata ai soli meningiomi anaplastici (grado III) e sarcomi (grado IV). I farmaci con i quali vi è maggiore esperienza sono: idrossiurea, Temozolomide, associazione PCV. Sono stati introdotti farmaci biologici come IFN alfa-2B, analoghi della somatostatina. Nuove frontiere sono rappresentate dagli anticorpi monoclonali: inibitori del PDFGR, EGFR, VEGFR. In realtà nessuna di queste terapie ad oggi ha dimostrato efficacia in termini assoluti; tali farmaci sono ancora sotto il vaglio della ricerca per comprenderne fino in fondo potenzialità ed indicazioni terapeutiche. Al San Raffale queste patologie sono curate con un approccio multidisciplinare all'avanguardia. Il Dr. Filippo Gagliardi si occupa della chirurgia della patologia gliale ed è membro responsabile della Disease Unit di Neuroncologia dell'ospedale, nonché referente per la Neurochirurgia.
Prognosi
La prognosi del meningioma dipende in modo essenziale dal grading istologico. Meningiomi di grado I sono patologie curabili e guaribili attraverso la chirurgia e la radiochirurgia ed una osservazione clinico-strumentale successiva. I meningiomi di grado II (meningiomi atipici) operati in modo radicale o subtotale con successiva radioterapia/radiochirurgia adiuvante vanno seguiti strettamente nel tempo, come fossero patologie maligne per l'elevato rischio di recidiva locale e progressione in forme più aggressive. I meningiomi anaplastici e i sarcomi, sono invece della patologie ad alta malignità. La prognosi dei pazienti affetti da queste forme tumorali risente dell'assenza, oltre alla chirurgia e alla radioterapia, di approcci terapeutici sistemici di efficacia validata e dimostrata. Meningiomi anaplastici e sarcomi tendono alla progressione e alla invasione del tessuto cerebrale e dei tessuti superficiali extracranici fino all'evoluzione definitiva.
Neurinomi
Epidemiologia
I neurinomi sono tumori benigni che originano dall’involucro che riveste i nervi periferici e i nervi cranici. Fra questi il più comune è il neurinoma del nervo acustico o VIII nervo cranico. I neurinomi sono tra i tumori primitivi più frequenti del sistema nervoso centrale. Rappresentano poco meno del 10% di tutti i tumori primitivi intracranici. Nell'adulto sono terzi per frequenza dopo gliomi e meningiomi con un’incidenza stimata annua di 1 nuovo caso su 100.000 persone. Le cellule di origine di questi tumori sono le cellule di Schwann, ovvero le cellule che si avvolgono attorno alle fibre nervose (assoni), costituendone l'isolante naturale. Il nervo cranico più frequentemente coinvolto, come precedentemente accennato, è il nervo stato-acustico nella sua componente vestibolare (anche detto VIII nervo cranico). In pratica é il nervo che conduce lo stimolo uditivo e regola l’equilibrio. Di seguito il nervo trigemino e il nervo facciale. I neurinomi colpiscono preferenzialmente il sesso femminile nell’età giovane/adulta (picco di incidenza nella quinta decade di vita). Sono caratterizzati da una crescita lenta, valutata in media di pochi millimetri all’anno. Considerata l'estrema prevalenza dei neurinomi dell'VIII nervo cranico, vi sarà dedicata gran parte della trattazione di questo paragrafo.
Anatomia patologica
I neurinomi si presentano come lesioni capsulate, extra-assiali (al di fuori dal tessuto cerebrale), di colore bianco-grigiastro e a superficie lobulata. Originano dalle cellule del rivestimento mielinico (cellule di Schwann) dei nervi periferici e dei nervi cranici. Sono la patologia più frequente che colpisce il nervo stato-acustico (VIII nervo cranico). Si localizzano prevalentemente a livello del suo segmento intra-meatale, ovvero del segmento che il nervo percorre all’interno del canale osseo, detto meato acustico interno.
Neurinomi dell'VIII nervo cranico
Crescono progressivamente, occupando completamente il meato e successivamente lo spazio cisternale (ovvero lo spazio liquido che circonda il tronco cerebrale), anche detto angolo ponto-cerebellare. In fase di crescita successiva il neurinoma entra progressivamente in contatto con il tronco dell’encefalo, una struttura ad elevato contenuto funzionale. Esso dà passaggio alle vie sensitive e motorie, che collegano cervello e midollo spinale e contiene i nuclei motori e sensitivi dei nervi cranici. Questi nervi veicolano gli stimoli che regolano l’attività motoria e la sensibilità della faccia, la lacrimazione, la salivazione, l’equilibrio, il movimento degli occhi, la reattività pupillare, la vista, l’udito, il gusto, la deglutizione e le funzioni vegetative del sistema vagale.
Nervi cranici
Sono 12 e prendono il nome dalle funzioni che veicolano. In ordine di numero crescente vi sono i nervi: olfattorio (I nervo cranico), ottico (II), oculomotore (III), trocleare (IV), trigemino (V), nervo abducente (VI), facciale (VII), nervo uditivo (VIII), glossofaringeo (IX), vago (X), accessorio spinale (XI) ipoglosso (XII). Crescendo, il tumore altera dunque la funzione uditiva (ipoacusia neurisensoriale) e vestibolare (alterazione dell’equilibrio) comprime il nervo facciale, alterando la motilità dei muscoli della faccia e il nervo trigemino, compromettendo la sensibilità del volto e la masticazione. In considerazione delle modalità di crescita del tumore è stata elaborata una scala, detta di Koos. Ne descrive dimensione e rapporti con le strutture adiacenti, graduandone la progressiva gravità. I neurinomi sono classificati dall’organizzazione mondiale della sanità come lesioni di grado I (WHO I) ovvero lesioni tendenzialmente benigne. Sono composti da cellule fusate associate a strutture fibrillari. La composizione cellulare è estremamente variabile.
Clinica
I pazienti con neurinoma del nervo acustico giungono di solito all’attenzione del medico per una perdita progressiva o acuta monolaterale dell’udito (ipoacusia) associata spesso ad acufeni (sensazione di fischi nell’orecchio). La funzione uditiva è valutata mediante un esame funzionale, l'audiometria vocale e tonale, con la scala di Gardner Robertson (che distingue 4 gradi, di cui il primo corrisponde ad una funzione uditiva normale).
Ipoacusia
può spesso associarsi a vertigine con conseguenti alterazioni dell’equilibrio. Nelle lesioni più grandi si assiste ad una compromissione della sensibilità dell’emivolto (ipoestesia) dovuta alla compressione del nervo trigemino. L’irritazione del nervo può esitare anche nella sindrome dolorosa meglio conosciuta come nevralgia del trigemino. Nei casi più gravi la crescita tumorale può interferire con la funzionalità del nervo facciale. Ció causa paresi più o meno grave della muscolatura mimica dell’emivolto con perdita della capacità all’ammiccamento (chiusura della palpebra) e conseguenti patologie oculari. La paresi del nervo facciale è classificata secondo la classificazione di House Brackmann in livelli di gravità crescente. La compressione del tronco dell’encefalo infine può causare, negli stadi più avanzati, emiparesi (perdita di motilità della metà controlaterale del corpo) fino alla tetraparesi (perdita della motilità dei 4 arti). La crescita intra-cisternale può portare il tumore in stretto contatto con i nervi cranici che presiedono la funzione deglutitoria, causando difficoltà a deglutire (disfagia). La compressione delle vie di deflusso del liquido cefalo-rachidiano, infine, determina la dilatazione dei ventricoli cerebrali. Queste cavità all’interno del cervello, dove circola il liquido cefalo-rachidiano, vengono interessate da una condizione che è conosciuta come idrocefalo, che rappresenta una potenziale urgenza neurochirurgica.
Diagnosi
In presenza di un quadro clinico sospetta per la presenza di un neurinoma acustico l’esame diagnostico per eccellenza è la risonanza magnetica con il mezzo di contrasto. Il neurinoma appare come una lesione che prende omogeneamente il mezzo di contrasto. In alcuni casi può presentare al suo interno aree cistico-necrotiche e piccole aree emorragiche. Il tumore assume la forma caratteristica di un cono-gelato. La parte intra-meatale corrisponde al cono, e la parte rigonfia localizzata a livello dello spazio cisternale dell’angolo ponto-cerebellare. La RM consente di valutare la dimensione del tumore. Ne valuta, anche, i rapporti critici con le strutture limitrofe e la presenza di idrocefalo. La diagnosi può essere completata da alcuni test funzionali come: l’audiometria vocale e tonale che consente di determinare la tipologia e l’entità della perdita dell’udito i potenziali evocati uditivi, un esame funzionale che consente di valutare lo stato di salute delle vie uditive e indirettamente del tronco encefalico, esaminando i tempi di conduzione dell’impulso uditivo.
Terapia
Oggi l'approccio terapeutico ai neurinomi dell'VIII nervo cranico è radicalmente cambiato, evolvendosi in tecniche sempre meno invasive. La radiochirurgia stereotassica con Gamma Knife ha progressivamente sostituito la chirurgia nel trattamento di questi tumori. Attualmente, la chirurgia è riservata solo in casi molto selezionati. I neurinomi piccoli, in pazienti che presentino già una grave compromissione dell’udito, possono essere seguiti nel tempo con risonanze di controllo e trattati alla prima evidenza di crescita. Neurinomi piccoli in pazienti con udito utile trovano da subito indicazione a trattamento radiochirurgico, visto l'alto tasso di preservazione dell'udito residuo in questa classe di pazienti. Neurinomi più voluminosi, di dimensioni superiori ai 3 centimetri di diametro massimo e con segni radiologici di compressione del tronco dell’encefalo, sono invece ancora candidati all'asportazione chirurgica mediante approccio retrosigmoideo. L'intervento, quando indicato, va eseguito in centri ad alta specializzazione. Al San Raffaele, per esempio, ci sono le attrezzature adeguate, tecnologie all'avanguardia ed esperienza professionale. In caso di residuo post-chirurgico, la radiochirurgia è il trattamento di scelta. Va sottolineato che la radiochirurgia sta progressivamente ampliando il suo campo d'azione. Ad oggi viene utilizzata anche per il trattamento di neurinomi di maggiori dimensioni, con ottimi risultati di controllo del tumore e di riduzione dei rischi di effetti collaterali, soprattutto nei termini di preservazione della funzione del nervo facciale. È necessario che il Paziente si rivolga ad una struttura ospedaliera che possa offrire entrambe le opzioni terapeutiche per poter selezionare in ogni caso il trattamento migliore, nell’ottica di una medicina personalistica ed individualizzata.
Prognosi
La prognosi oncologica dei neurinomi dell'VIII nervo cranico è generalmente buona. La radiochirurgia ha dimostrato controllo della crescita lesionale come trattamento primario in oltre il 96% dei casi, lievemente più bassa, ma comunque al di sopra del 90%, il controllo dei residui post-chirurgici. Dopo exeresi completa, il tumore si considera guarito. In ogni caso è prudente un monitoraggio clinico e strumentale per diversi anni dopo il trattamento. Cosí si intercettano eventuali recidive, anche se rare, e le si possono trattare tempestivamente. La prognosi funzionale dei pazienti, una tempo gravata dal rischio chirurgico, è stata rivoluzionata in senso positivo con l'introduzione della radiochirurgia. Si pensi solo che il tasso di deficit del nervo facciale dopo chirurgia raggiungeva il 30% e oggi, con la Gamma Knife è meno del 3%.
Caso clinico
Consulta il caso clinico di neurinoma dell'VIII nervo cranico trattato con radiochirurgia stereotassica.
Malformazioni artero-venose cerebrali
Le malformazioni artero-venose cerebrali, o MAV, sono malformazioni che interessano la disposizione e la connessione fra vene e arterie nel cervello. Rappresentano una condizione tipicamente congenita. In particolare la MAV consiste in un groviglio di vasi dilatati. Esso crea un anomalo sistema di comunicazione tra il sistema arterioso e quello venoso in assenza di un circolo capillare. Il sangue arterioso ad alta pressione passa direttamente nelle vene senza passare attraverso il letto capillare, dove abbassa naturalmente la sua pressione di flusso. Pertanto le vene a valle, sollecitate da una pressione intra-murale innaturalmente elevata, tendono a dilatarsi e a formare i cosiddetti aneurismi di flusso. Si possono pertanto considerare concettualmente come fistole artero-venose. In altri termini le MAV sono un'anomalia di sviluppo, rappresentata dalla persistenza di un sistema vascolare embrionale, che può ulteriormente proliferare ed espandersi con il passare del tempo. Si tratta di malformazioni vascolari in cui, per un errore embriologico, in un certo distretto vascolare, viene a mancare il sistema dei capillari. Perció le arterie riversano sangue arterioso direttamente nelle vene. Questo si traduce nell’immissione di sangue ad elevata pressione all’interno del sistema venoso. Ne consegue un rischio potenziale di rottura della parete venosa.
Anatomia patologica
Le MAV variano per dimensione. Da una piccola malformazione di pochi millimetri di diametro localizzata nella corteccia cerebrale (sostanza grigia) o nella sostanza bianca a grandi masse di vasi tortuosi che, in rari casi, comprendono uno shunt artero-venoso di grandezza tale da aumentare la gittata cardiaca. La MAV è costituita da una parte centrale detta nidus. Qui afferiscono arterie afferenti (afferenze arteriose) a pettine. Fuoriescono scarichi venosi tortuosi e dilatati con eventuali aneurismi di flusso. Tra le strutture vascolari è normalmente presente del parenchima cerebrale sano e funzionante. Più nel dettaglio, in prossimità della malformazione principale si trovano arterie afferenti ipertrofiche e dilatate, che scompaiono al di sotto della corteccia. Esse si suddividono, poi, in una rete di vasi dalle pareti sottili, i quali si connettono direttamente con le vene drenanti (scarichi venosi). Queste ultime formano spesso vasi pulsanti molto dilatati, che drenano il sangue arterioso. La situazione che si viene a creare è quella di vene (con parete quindi sottili rispetto alle arterie) soggette ad una pressione 100 volte superiore a quella che di solito devono sopportare. È possibile, pertanto, che una vena dilatata dal sangue arterioso possa rompersi e dare una emorragia. Se si rompe una vena superficiale a contatto con lo spazio subaracnoideo la sua rottura determina una emorragia subaracnoidea. Se il vaso che si rompe è profondo, ovvero all’interno del parenchima cerebrale, si avrà una emorragia intra-parenchimale (intracerebrale).
Clinica
I sintomi e segni clinici dipendono dalla localizzazione dell'anomalia. Più dell' 80% dei pazienti è asintomatico. Sebbene la lesione sia presente dalla nascita, l'inizio dei sintomi si ha generalmente tra il 10º e il 30º anno di età. Occasionalmente può essere ritardato fino a 50 o più anni di età. La prima manifestazione clinica delle malformazioni artero-venose cerebrali, nella metà circa dei pazienti, è l'emorragia (subaracnoidea, intra-parenchimale, sottodurale). La prima emorragia, se massiva, può essere letale. In oltre il 90% dei casi, peró, l'emorragia si auto-limita. Il rischio cumulativo di emorragia è di circa il 4%/anno (in dieci anni quindi la probabilità di sanguinamento è del 40%). Nel 30% dei pazienti, la prima e unica manifestazione è costituita da una crisi epilettica, nel 20% da cefalea. La crisi epilettica può essere causata da micro-sanguinamenti con stravaso di sangue nel parenchima cerebrale. Ne consegue un effetto irritativo sulla corteccia cerebrale che puó generare crisi epilettiche. Le MAV giganti possono provocare un deficit neurologico lentamente progressivo, a causa della compressione di strutture adiacenti da parte della massa vascolare in espansione. I canali vascolari molto dilatati della MAV possono inoltre deviare a loro favore il circolo sanguigno, in quanto offrono meno resistenza al flusso, e generare una ipo-perfusione del tessuto normale circostante (emostorno). Infatti una MAV, indipendentemente dalla emorragia, può dare deficit neurologici perché essa è un sistema a bassa pressione e si comporta come una spugna. In altre parole il sangue preferisce prendere la via della MAV anziché la via dei capillari che vanno a nutrire il tessuto circostante. Progressivamente può instaurarsi una ischemia cerebrale che nelle aree critiche può avere come conseguenza un deficit neurologico.
Diagnosi
- RM cerebrale e Angio-RM. Il 95% delle MAV è evidenziato da una RM encefalo con mezzo di contrasto, con una buona definizione dell’architettura della stessa malformazione.
- Angiografia. L'angiografia cerebrale è l’esame diagnostico per eccellenza, fornendo la diagnosi di certezza e definendo nel modo più preciso l’anatomia vascolare della malformazione e le caratteristiche di flusso.
Trattamento
Il trattamento delle malformazioni artero-venose varia a seconda dei casi; tradizionalmente si ricorreva alla chirurgia o alla radioterapia. Negli ultimi decenni la Radiochirurgia stereotassica ha dimostrato eccellenti risultati nel trattamento di queste malformazioni. Lo scopo principale del trattamento è quello di prevenire l'emorragia attraverso l'obliterazione della malformazione.
Chirurgia
L'escissione microchirurgica della MAV è praticabile solo nel 20% dei casi. La percentuale di mortalità intraoperatoria è pari al 2-5% con una morbidità variabile dal 5 al 25%.
Trattamento endovascolare
In altri casi sono stati intrapresi tentativi volti a obliterare i vasi malformati per mezzo dell’embolizzazione artificiale mediante utilizzo di sostanze sintetiche a presa rapida. Queste vengono iniettate da un palloncino, pervenuto in loco tramite un vaso afferente. Si procede tramite l'arteria femorale fino all’arteria che nutre il nidus della MAV. Si iniettano, poi, particelle o colla (che solidifica al contatto con il sangue). Vi è un 5% di rischio di complicanze. Le particelle o la colla "scappano" per via venosa e trombizzano o migrano fino alle arterie polmonari. Altra possibile complicanza è l'obliterazione di un'arteria che nutre il parenchima cerebrale. Il trattamento endovascolare è efficace nella completa obliterazione solo nel 10% dei casi. Il rimanente 90% deve essere sottoposto a successivo trattamento microchirurgico o radiochirurgico.
-
Radiochirurgia
È l'irradiazione con raggi gamma della MAV con modalità stereotassica. Sfrutta il fatto che le radiazioni hanno il potere di indurre, nel giro di due anni, una proliferazione endoteliale endovascolare con chiusura progressiva e la ialinizzazione della malformazione. L'efficacia della radiochirurgia è valutata intorno al 90% entro due anni e comporta un rischio di morbidità di circa il 3%. Negli ultimi decenni la radiochirurgia ha in gran parte soppiantato la chirurgia nel trattamento di queste lesioni. I risultati clinici ottenuti sono ottimi, grazie a un trattamento mini-invasivo e un basso rischio di danni peri-procedurali.
Prognosi
La prognosi delle MAV è generalmente buona, con buon recupero funzionale nei pazienti sottoposti a trattamento. Diverso è il caso di pazienti vittime di emorragia, sia essa subaracnoidea, intra-parenchimale o sottodurale. I postumi funzionali e neurologici possono essere estremamente severi ed invalidanti. Il rischio di mortalità e morbilità permanente é estremamente elevato.
Ernia del disco
L'ernia del disco intervertebrale è il risultato di una dislocazione e fuoriuscita di materiale normalmente contenuto nel disco intervertebrale (nucleo polposo), all’interno del canale vertebrale. Il frammento, facendosi spazio tra le fibre lesionate dell'anulus fibroso del disco, viene a contatto con le strutture nervose contenute nel canale spinale, la dura meninge e/o le radici nervose. L'ernia va quindi a comprimere le radici nervose, il midollo spinale, il cono midollare e la cauda generando la clinica. Nel disco normale l'anello fibroso, costituisce un perfetto apparato di contenimento del nucleo polposo che è al suo interno. Assai frequentemente l'ernia è associata a una pregressa degenerazione del disco, intesa sia come rimaneggiamento del suo contenuto, che come alterazione e danno delle fibre dell'anulus.
Epidemiologia
L’ernia del disco può coinvolgere il segmento cervicale, dorsale e lombo-sacrale del rachide, con frequenza prevalente in regione lombare/lombosacrale e cervicale; le ernie del disco dorsali sono molto più rare. Se la patologia dell'ernia del disco intervertebrale si manifesta principalmente a livello cervicale e lombare, è perché questi segmenti giocano un ruolo fondamentale nella mobilità della colonna vertebrale.
Ernia lombare
Porta a dolore locale (lombalgia) e spesso associato a dolore irradiato alle gambe (sciatalgia/cruralgia) detta anche comunemente sciatica. Essa si verifica 15 volte più frequentemente rispetto all’ernia cervicale (a livello del collo), ed è una delle più comuni cause di dolore lombare. L'ernia cervicale è responsabile invece di dolore cervicale (cervicalgia), dolore irradiato al braccio per compressione di un nervo (brachialgia o cervico-brachialgia) e nei casi più gravi alla compressione del midollo spinale (mielopatia). La maggior parte delle ernie del disco si verifica nella quarta e quinta decade di vita; nella giovane età infatti il nucleo polposo è ancora una sostanza gelatinosa. Con l'età il nucleo polposo tende a "asciugarsi" e quindi il rischio di ernia si riduce. Dopo i 50 anni, la spondilosi o la stenosi spinale sono le cause più probabili di mal di schiena o dolore alle gambe. Il 4,8% dei maschi e il 2,5% delle femmine con più di 35 anni sperimenta la sciatica almeno una volta durante vita, con un 60% all' 80% di individui che sperimenta almeno una volta nella vita mal di schiena, fino al vero e proprio blocco antalgico lombare (colpo della strega) o cervicale (colpo di frusta). Nel 14% dei casi il dolore dura più di 2 settimane. In generale, i maschi hanno un’incidenza leggermente superiore rispetto alle femmine di contrarre questo disturbo.
Classificazione
Le ernie possono essere classificate:
- In rapporto alla sede topografica, di cui le più frequenti sono l’ernia del disco compreso tra le vertebre L5-S1 e L4- L5.
- In rapporto al grado di fuoriuscita del nucleo:
- Ernia contenuta: quando il disco presenta una sporgenza circoscritta nel canale vertebrale (l'anulus è sfiancato ma non completamente rotto). L'ernia risulta pertanto contenuta dal legamento longitudinale.
- Ernia protrusa: (da non confondere con la protrusione) è una vera e propria ernia, che consiste nello spostamento parziale del nucleo polposo, a livello del canale spinale, che quindi rompe le fibre dell'anulus e il legamento longitudinale, ma rimane, seppur in parte, attaccato al centro del disco.
- Ernia espulsa o migrata: quando vi è rottura dell'anulus e fuoriuscita nel canale vertebrale di materiale discale che migra verso l'alto o il basso. Di solito questo tipo di ernie vanno incorno ad una progressiva disidratazione e riassorbimento.
- Protrusione discale, bulging discale: si definisce come uno spanciamento del disco verso il canale vertebrale con il disco che mantiene la sua integrità strutturale.
- In base alla sede e il rapporto con il forame di coniugazione, le ernie si possono ulteriormente classificare in:
- pre-foraminali
- intra-foraminali
- extra-foraminali
Eziologia
La fuoriuscita del nucleo polposo, la porzione più idratata e compatta del disco, è determinata dal cedimento degli strati periferici, detti anulus fibroso. Si tratta di un complesso di lamine concentriche (a buccia di cipolla), man mano meno idratate e più fibrose dal centro alla periferia. Solitamente tale cedimento avviene nell'ambito di un lento processo degenerativo a carico di tutto il complesso osteo-articolare tra una vertebra e l'altra. Ne consegue che i più coinvolti siano soggetti appartenenti a fasce di età medio-avanzata. La vita sedentaria, il sovrappeso e il ripetersi di ripetuti micro-traumi sulla colonna vertebrale può provocare una precoce degenerazione di tali strutture anatomiche. Questo puó portare al manifestarsi clinico di queste patologie anche in età giovanile. La genesi della sintomatologia è dovuta dalla fuoriuscita dell'ernia in una direzione posteriore o postero-laterale alla normale situazione anatomica del disco intervertebrale. Così si va a comprimere e danneggiare le strutture nervose. L'ernia del disco è spesso legata ad una predisposizione costituzionale. Successivamente puó essere compromessa da varie cause come stress e traumi vertebrali, protratte posture viziate, distribuzione non uniforme di carichi sulla colonna ed altri. Il fumo, l'uso eccessivo dell'automobile e il sovrappeso sono noti fattori favorenti l'usura del disco e, quindi, la formazione di un'ernia.
Clinica
Molte ernie sono asintomatiche. In quelle sintomatiche l'ernia del disco si manifesta clinicamente in rapporto alla regione anatomica colpita, alla grandezza e alla dinamica della fuoriuscita del materiale discale. Si hanno dolori vertebrali, cervicali, dorsali o lombari, a seconda della sede dell'ernia, ed eventuali disturbi da compressione delle strutture nervose (midollo spinale e radici nervose) che si trovano nel canale vertebrale. In generale si distinguono segni di danno radicolare (ossia a carico delle radici nervose compresse dall'ernia) danno midollare (a carico del midollo spinale). Si distingue inoltre: una prima fase molto precoce caratterizzata da una sindrome irritativa, sostanzialmente da dolore una seconda fase subacuta con manifestazioni deficitarie, ossia di vero danno sensitivo/motorio a carico delle radici nervose e/o del midollo compresso dall'ernia. L’ernia del disco può causare, quindi, sofferenza radicolare con irritazione/danno a distribuzione nel rispettivo metamero, così come sofferenza midollare, caratterizzata da compressione del primo motoneurone (vie piramidali) con sofferenza delle vie sensitive (sindrome cordonale). Una compressione del midollo spinale da parte di un disco erniato inoltre può determinare un quadro di conflitto vascolare acuto, con danno ischemico centromidollare, o cronico, con comparsa di gliosi reattiva.
Ernia del disco cervicale
Si osservano più di frequente ai livelli cervicali medio inferiori (C4-C5, C5-C6 e C6-C7), mentre in quelli superiori intervengono molto più di rado. Nel rachide cervicale insieme alle radici nervose presenti a ogni metamero transita il tratto di midollo spinale con funzioni sensitivo-motorie. Sintomatologia dell'ernia cervicale:
- dolore cervicale
- cervico-brachialgia
- dolori precordiali e scapolari
- disturbi di sensibilità, motilità, trofismo e riflessi agli arti superiori
- disturbi di sensibilità, motilità e riflessi agli arti inferiori
- tetraparesi
- disturbi sessuali
- disturbi sfinterici
Sintomatologia dell'ernia dorsale:
- dolore dorsale
- dolore intercostale
- disturbi di sensibilità, motilità e riflessi agli arti inferiori
- paraparesi
- disturbi sessuali
- disturbi sfinterici
Sintomatologia dell'ernia lombare:
- dolore lombare
- lombo-sciatalgia o sciatica
- lombo-cruralgia
- disturbi di sensibilità, motilità, trofismo e riflessi agli arti inferiori
- paraparesi
- difficoltà a stare fermi a lungo in piedi
- disturbi sessuali
- disturbi sfinterici
Sintomatologia dell'ernia del disco lombare
È la più frequente e inizia in genere con una lombalgia acuta associata a sciatalgia. Nella maggior parte dei casi si ha la guarigione spontanea, da un minimo di quattro settimane ad alcuni mesi. Nei casi di deficit neurologici (perdita di forza o di sensibilità) si ricorre all'intervento chirurgico. Il vero problema dell'ernia del disco non è tanto il singolo episodio, che può guarire, bensì la tendenza alle recidive successive. La probabilità di recidive non viene sostanzialmente modificata dall'intervento chirurgico.
Diagnosi
- RM del rachide. La risonanza magnetica è l’esame di scelta per la valutazione di un Paziente con ernia del disco. Essa consente di valutare lo stato di salute dei legamenti, dei dischi intervertebrali, e delle strutture nervose quali midollo spinale e radici nervose.
- Elettromiografia. E’ un esame funzionale che consente di valutare lo stato di salute e l’efficienza di conduzione delle radici nervose e dei nervi periferici.
Terapia
Il trattamento di un'ernia può essere:
- Conservativo (riposo, fisioterapia, farmaci, infiltrazioni)
- Chirurgico mini-invasivo (microchirurgia)
L’approccio terapeutico è quindi multimodale e va valutato caso per caso dallo specialista neurochirurgo. Forme lievi possono giovarsi di riposo, terapia fisica e medica conservativa. Ulteriori alternative sono le infiltrazioni.
Terapia fisica
Comprende la fisioterapia e la ginnastica posturale per il recupero funzionale della muscolatura e per risolvere eventuali contratture muscolari concomitanti. L'indicazione non può prescindere dalla valutazione specialistica neurochirurgica.
Terapia medica
Si avvale dell'utilizzo di anti-infiammatori, miorilassanti, farmaci neuromodulatori, integratori di fattori neurotrofici che aiutano il recupero funzionale del nevo e il cortisone nei casi più gravi. Questi farmaci devono essere necessariamente prescritti dallo specialista neurochirurgo, perché ognuno di essi ha una sua specifica indicazione e posologia. Alla terapia fisica e medica si può associare l'utilizzo di un'ortesi in casi selezionati (busto semirigido lombare nella stenosi lombare, collare morbido nella stenosi cervicale). Anche in questo caso l'indicazione va data dallo specialista neurochirurgo. Le infiltrazioni perdurali di cortisone, cosi come le infiltrazioni di punti trigger (punti grilletto che scatenano il dolore), dei processi articolari, le infiltrazioni peri-radicolari o foraminali sono tutti approcci da considerare. Il Dr. Gagliardi ha esperienza in merito anche a queste tecniche, avendo frequentato corsi specifici all'estero.
Terapia chirurgica
Prevede di norma un intervento detto di erniectomia/microdisectomia.
Erniectomia/microdiscectomia cervicale. E' un intervento mini-invasivo (incisione di pochi centimetri nella parte antero-laterale del collo), eseguito in anestesia generale. I tempi di recupero sono rapidi con una degenza media di un paio di giorni. Il Paziente dopo l'intervento mantiene il collare cervicale per circa un mese, ma il giorno dopo l'intervento è già in piedi e torna progressivamente alle sue attività quotidiane. Non è un intervento doloroso.
Erniectomia/microdiscectomia lombare. E' un intervento mini-invasivo (incisione di pochi centimetri sulla schiena a livello dello spazio vertebrale interessato), eseguito in anestesia generale. I tempi di recupero sono rapidi con una degenza media di un paio di giorni. Il Paziente il giorno dopo l'intervento è già in piedi e torna progressivamente alle sue attività quotidiane. Anche in questo caso, non è un intervento doloroso.
Accanto alle tecniche di microchirurgia vanno citate le procedure endoscopiche e le procedure percutanee. L'endoscopia spinale consente di approcciare le ernie del disco utilizzando un endoscopio rigido, ovvero uno strumento ottico con una propria fonte di illuminazione e la possibilità di ingrandimento. L'approccio è minimamente invasivo, tuttavia, la manovrabilità chirurgica e l'esposizione sono spesso limitate a causa delle ristrette dimensioni del canale di lavoro.
Procedure percutanee
Sono delle tecniche che utilizzano sonde rigide delle dimensioni di un grosso ago per raggiungere il disco intervertebrale grazie alla guida della fluoroscopia. Infine, una volta raggiunto il target, si passa a "sciogliere" chimicamente (chemonucleolisi) o fisicamente l'ernia del disco (nucleotomia, nucleoplastica percutanea, discectomia laser). Anche in questo caso manovrabilità ed esposizione chirurgica sono spesso limitate. L'impossibilità ad una visione diretta riduce potenzialmente il controllo della procedura da parte dell'operatore. Qualora la discopatia abbia caratteristiche d grave degenerazione discale o instabilità secondaria, esiste un trattamento chirurgico maggiore. Si tratta di interventi chirurgici di stabilizzazione vertebrale per ripristinare l’altezza del disco, il corretto assetto della colonna vertebrale sul piano sagittale e coronale, la correzione di altre anomalie tra cui la scoliosi e la perdita di lordosi. Data l’estrema varietà di situazioni, il trattamento va programmato caso per caso dallo specialista neurochirurgo ed eseguito in centri specializzati come il San Raffaele.
Prognosi
La prognosi di queste patologie è di norma buona con un potenziale completo recupero dei sintomi pre-operatori. Come per la stenosi spinale, va considerata tuttavia l'entità della sofferenza delle strutture nervose e il tempo di persistenza dei sintomi. Quanto maggiore è tale sofferenza e quanto più lunga è la storia naturale, tanto il danno può essere più difficile da correggere. Il consiglio comunque è di rivolgersi a neurochirurghi e centri specializzati.
In particolare sulle ernie lombari
... sulle ernie cervicali
... sulle ernie dorsali
Stenosi spinale
La stenosi spinale (canale stretto) è un restringimento anormale (stenosi) del canale spinale (speco vertebrale) che può verificarsi in uno dei segmenti della colonna vertebrale. Essa è il risultato di fenomeni degenerativi cronici (artrosi) che intervengono in modificazioni permanenti dell’apparato osteo-articolare della colonna vertebrale. Le principali cause di restringimento del canale vertebrale sono:
- Ipertrofia (aumento dimensionale) dei legamenti (in particolare il legamento giallo, ipertrofia dei legamenti gialli)
- Ipertrofia degenerativa dei massicci articolari (strutture anatomiche con cui si articolano le vertebre)
- Formazione di osteofiti (ponti ossei tra le vertebre)
- Protrusione/erniazione del disco intervertebrale
Questo restringimento può coinvolgere prevalentemente il canale vertebrale o i forami di coniugazione, ovvero i canali ossei da cui escono le radici spinali, detta pertanto stenosi foraminale.
Epidemiologia
La stenosi spinale è una patologia estremamente diffusa nella popolazione generale. Le fasce di età prevalentemente colpite da questa patologia sono l’età adulta e anziana.
Clinica
I sintomi della stenosi vertebrale includono:
- Dolore locale ed irradiato agli arti inferiori
- Deficit di sensibilità
- Parestesie formicolanti
- Perdita di controllo motorio
La posizione della stenosi determina quale zona del corpo è influenzata dalla clinica. Vi sono diversi tipi di stenosi spinale; la stenosi lombare e la stenosi cervicale sono le forme più frequenti. La stenosi spinale lombare è la forma più comune, quella cervicale invece è più pericolosa perché comporta la diretta compressione del midollo spinale. Nella stenosi lombare la compressione coinvolge invece le radici nervose terminali del midollo spinale dette “cauda equina”.
Stenosi cervicale
La stenosi cervicale è un restringimento del canale spinale a livello del rachide cervicale. Essa condiziona la compressione del midollo spinale con conseguente sofferenza dello stesso. I sintomi più frequenti possono essere disturbi nella deambulazione e debolezza alle gambe fino alla paresi. Associati ai sintomi condizionati dalla mielopatia (sofferenza compressiva del midollo spinale) possono associarsi disturbi dati dalla compressione delle radici nervose che innervano le braccia. Ne conseguono dolori che si irradiano dal collo alle braccia detti cervico-brachialgia e disturbi sensitivi e motori alle braccia fino ad un franco quadro, nei casi più gravi, di paresi ai quattro arti. Classicamente il dolore radicolare si irradia dal collo lungo tutto l'arto superiore spesso fino alle dita della mano, peggiora la notte e può associarsi a disturbi di sensibilità come dolori urenti (disestesie), formicolii (parestesie), sensazione di "elettricità" lungo il nervo. Questi sintomi si raggruppano nella definizione di dolore neuropatico.
Stenosi lombare
La stenosi lombare è un restringimento del canale spinale a livello del rachide lombare. Essa si estrinseca con una sintomatologia tipica detta “claudicatio neurogena” . Si tratta della comparsa di dolore irradiato alle gambe durante la deambulazione. I pazienti sono in grado di percorrere una distanza detta “intervallo libero da dolore” . Questa varia in base al grado di severità della stenosi. Il paziente, poi, inizia a percepire dolore e deve fermarsi. Dopo alcuni minuti di riposo, il dolore passa. Anche in questo caso il dolore è un dolore neuropatico.
Stenosi lombare: dolori
Classicamente il dolore si irradia lungo il decorso del nervo. Se coinvolge la regione laterale e posteriore della coscia, il polpaccio fino al piede viene detta sciatalgia, se invece coinvolge la faccia anteriore della coscia si definisce cruralgia. Possono associarsi disturbi sfinterici, la più frequente è la ritenzione urinaria (incapacità di urinare) e deficit motori agli arti inferiori (sensazione di cedimento della gamba) fino, nei casi più gravi ad una vera e propria paresi agli arti inferiori (paraparesi). E' fondamentale valutare l'eventuale presenza di dolore lombare associato che spesso può essere dovuto ad un quadro di sofferenza dei dischi intervertebrali (discopatia), della articolazioni vertebrali (ipertrofia dei massicci articolari), infiammazione della capsula sinoviale (sinovite), edema dell'osso (segni di Modic legati ad un quadro infiammatorio), che posso sottendere ad un quadro di instabilità vertebrale. Altra causa di instabilità vertebrale è rappresentata dalla spondilolistesi degenerativa e malformativa. Per spondilolistesi si intende lo scivolamento di due vertebre contigue. Lo scivolamento può essere anteriore (anterolitesi) o posteriore (retrolsitesi). Viene graduata in base all'entità dello scivolamento secondo la classificazione di Mayerding in 4 livelli di gravità crescente. La spondilolistesi malformativa può essere l'esito dalla mancanza dell'istmo vertebrale, questa condizione è detta spondilolisi o dalla assenza dell arco vertebrale posteriore, la schisi vertebrale.
Diagnosi
La diagnosi della stenosi lombare è una diagnosi primariamente clinica. A conferma dell’ipotesi diagnostica è necessario sottoporre il Paziente ad accertamenti strumentali mirati.
- RM del rachide. La risonanza magnetica è l’esame di scelta per la valutazione di un Paziente con stenosi vertebrale. Essa consente di valutare lo stato di salute dei legamenti, dei dischi intervertebrali, dell'osso e delle strutture nervose quali il midollo spinale, cono midollare e le radici nervose
- TC del rachide. La TC è un esame complementare alla RM poiché consente di valutare lo stato di salute dell’osso vertebrale ed eventuali casi di instabilità osteo-legamentosa, che richiedano una successiva stabilizzazione vertebrale. Esclude la presenza di fratture vertebrali (soprattutto le fratture da osteoporosi)
- RX del rachide con proiezioni dinamiche e bending laterale. E’ un esame radiologico che studia il Paziente durante l’esecuzione delle manovre di massima estensione e flessione della colonna, e di bending laterale (flessione sul fianco) così da rilevare eventuali movimenti patologici (scivolamenti, listesi, olistesi, anterolistesi, retrolistesi, sublussazioni rotatorie) tra le vertebre. La lastra fatta, a paziente in piedi (in carico), consente di valutare la curvatura della colonna vertebrale, il bilanciamento sagittale e coronale, identifica quindi eventuali situazioni di iperlorodosi, ipercifosi, rettilineizzazione del rachide, scoliosi
- EMG (elettromiografia). E’ un esame funzionale che consente di valutare lo stato di salute e l’efficienza di conduzione delle radici nervose e dei nervi periferici. Identifica eventuali stati di denervazione acuta o cronica,danno assonale, radicolopatia, sofferenza tronculare, neuropatia, polineuropatia
- Potenziali evocati motori e sensitivi. Sono esami funzionali che consentono di valutare lo stato di salute del midollo spinale, studiando la conduzione dell’impulso nervoso attraverso le fibre nervose (assoni) del midollo stesso (fasci pirmamidali e cordoni posteriori).
Terapia
L’approccio terapeutico alla stenosi vertebrale è multimodale e va valutato caso per caso dallo specialista neurochirurgo. Forme lievi possono giovarsi di riposo, terapia fisica e medica conservativa. Ulteriori alternative sono le infiltrazioni. La terapia fisica comprende la fisioterapia e la ginnastica posturale per il recupero funzionale della muscolatura e per risolvere eventuali contratture muscolari concomitanti. L'indicazione non può prescindere dalla valutazione specialistica neurochirurgica.
Terapia medica
La terapia medica si avvale dell'utilizzo di anti-infiammatori, miorilassanti, farmaci neuromodulatori, integratori di fattori neurotrofici che aiutano il recupero funzionale del nevo e il cortisone nei casi più gravi. Questi farmaci devono essere necessariamente prescritti dallo specialista neurochirurgo, perché ognuno di essi ha una sua specifica indicazione e posologia. Alla terapia fisica e medica si può associare l'utilizzo di un'ortesi in casi selezionati (busto semirigido lombare nella stenosi lombare, collare morbido nella stenosi cervicale). Anche in questo caso l'indicazione va data dallo specialista neurochirurgo. Le infiltrazioni perdurali di cortisone, cosi come le infiltrazioni di punti trigger (punti grilletto che scatenano il dolore), dei processi articolari, le infiltrazioni peri-radicolari o foraminali, l'ozonoterapia sono tutti approcci da considerare. Il Dr. Gagliardi ha esperienza in merito anche a queste tecniche, avendo frequentato corsi specifici all'estero.
Terapia del dolore
L'approccio della terapia del dolore (approccio palliativo) è da considerarsi nel caso di pazienti anziani con tante patologie (comorbidità). Essa include l'utilizzo di un approccio farmacologico dedicato, e nei casi più estremi di impianto di stimolatori midollari per il controllo del dolore. Anche in questo caso l'indicazione va data dallo specialista neurochirurgo.
Interventi
I casi più gravi possono necessitare di un intervento chirurgico di decompressione delle strutture nervose, ad esempio laminectomia, recalibrage, foraminotomia, laminotomia osteoplastica, laminotomia open-door. A questo può associarsi, quando indicato, un consensuale intervento di stabilizzazione (artrodesi) della colonna con il posizionamento di viti peduncolari e barre laterali in titanio. Si può inoltre valutare l'utilizzo di gabbiette (cage) da sostituire al disco intervertebrale attraverso diverse tecniche di impianto PLIF, TLIF, XLIF, ALIF. Il Dr. Gagliardi è specializzato in queste tecniche.
Prognosi
La stenosi lombare e la stenosi cervicale sono entrambe patologie degenerative, ovvero patologie che sono esito di processi di invecchiamento delle strutture osteo-legamentose della colonna vertebrale e che intervengono nell'arco di anni. I sintomi sono perciò lentamente progressivi, sono rarissime le evoluzioni rapide verso deficit neurologici maggiori. Questa relativa indolenza della patologia ne consente di norma un adeguato inquadramento diagnostico per selezionare l'approccio terapeutico più adeguato. Esso deve tenere necessariamente in conto non solo le caratteristiche della patologia, ma soprattutto le caratteristiche del paziente. Di norma la prognosi di queste condizioni è buona, con buone potenzialità di recupero dei disturbi lamentati. Va considerata tuttavia l'entità della sofferenza delle strutture nervose e il tempo di persistenza dei sintomi. Quanto maggiore è tale sofferenza e quanto più lunga è la storia naturale, tanto il danno può essere più difficile da correggere. Il consiglio comunque è di rivolgersi a neurochirurghi e centri specializzati.
Patologie traumatiche del rachide lombare
Artrodesi lombare posteriore per frattura lombare
Caso di stabilizzazione dalla terza (L3) alla quinta (L5) vertebra lombare in seguito a frattura post-traumatica della quarta vertebra lombare (L4) dovuta ad un incidente stradale. La stabilizzazione è stata eseguita con approccio posteriore mediante viti trans-peduncolari e barre in titanio. La Figura A mostra la proiezione sagittale (o laterale) della colonna vertebrale all’esame TC post-operatorio. Le viti sono in sede e correttamente posizionate all’interno dei peduncoli vertebrali. Le Figure B, C e D mostrano le viti in proiezione assiale sui tutti e tre i livelli trattati (L3, L4, L5). La Figura E rappresenta la ricostruzione tridimensionale del costrutto dopo l’intervento.
Posizionamento di Spine Jack per frattura lombare
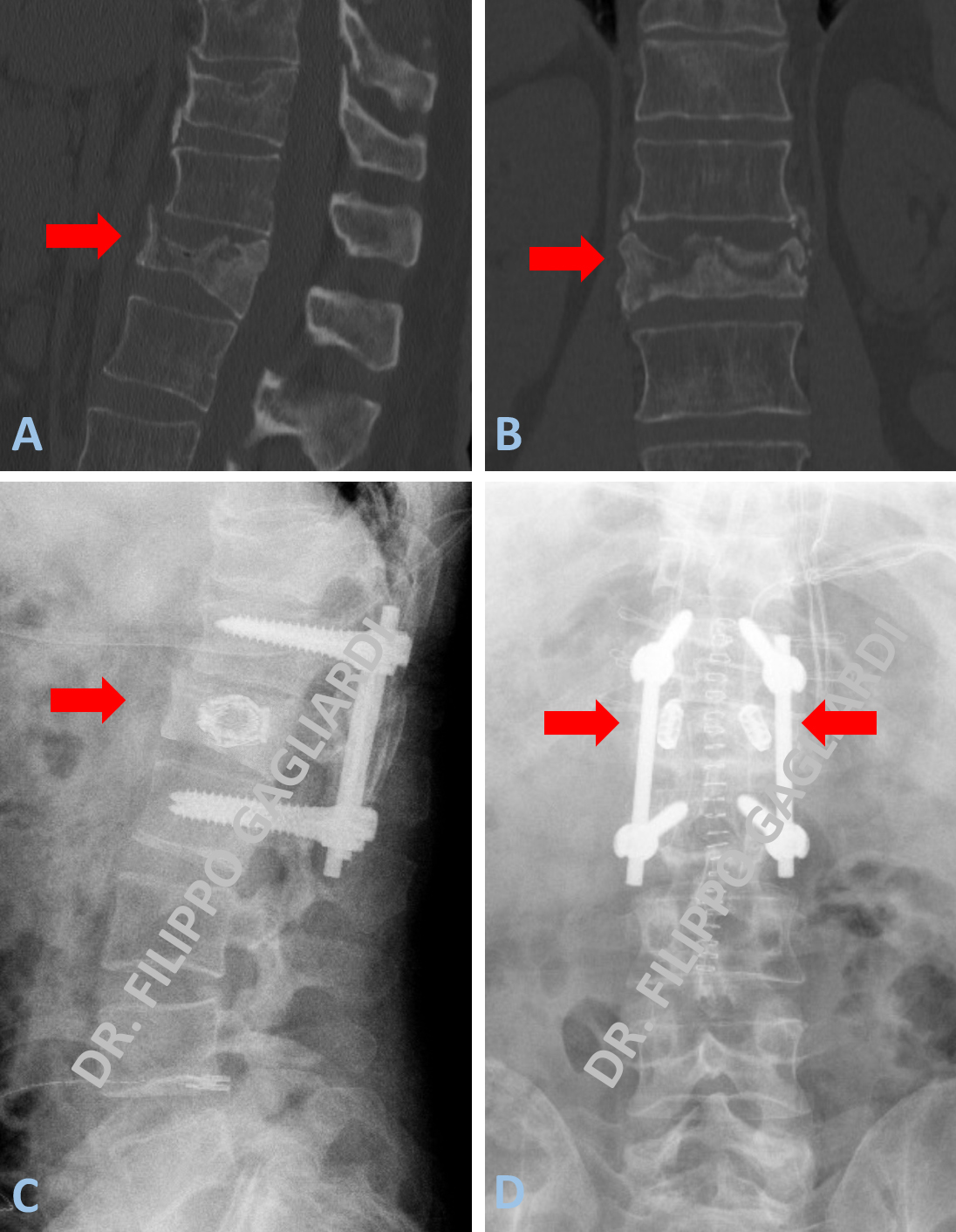
Caso di frattura di una vertebra lombare (frecce rosse delle Figure A e B) associato ad instabilità della colonna vertebrale. Il paziente è stato sottoposto ad un intervento di:
- stabilizzazione vertebrale per via posteriore (viti e barre)
- posizionamento di doppio Spine Jack per via transpeduncolare.
Lo Spine Jack (frecce rosse delle Figure C e D) è un dispositivo che consiste in una rete metallica che si inserisce con tecnica mininvasiva e si dilata una volta inserito nel punto desiderato. La dilatazione del dispositivo consente di rimodellare la vertebra fratturata restituendole la forma e la stabilità di una vertebra sana. La Figura A e B mostrano lo studio TC pre-operatorio rispettivamente nella proiezione laterale e frontale, la Figura C e D lo studio RX post-operatorio, rispettivamente nella proiezione laterale e frontale.

