Neuropatie compressive periferiche
Neurolisi del nervo ulnare al gomito
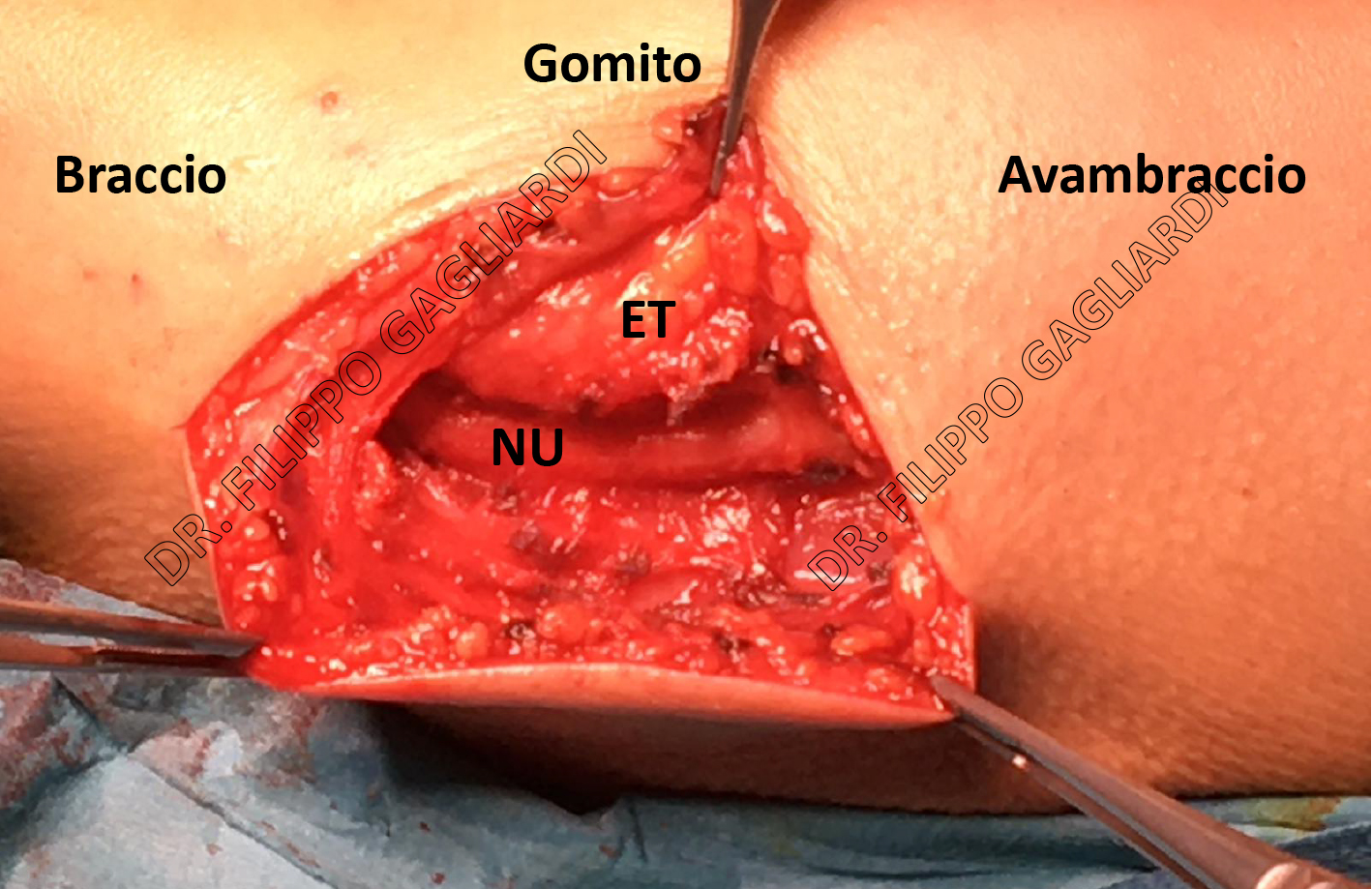 Neurolisi del nervo ulnare al gomito Caso di neurolisi di nervo ulnare al gomito. Al termine dell'intervento il nervo ulnare (NU) risulta libero da qualsiasi compressione nel suo canale anatomico naturale, il canale cubitale. Il canale si trova subito posteriormente all'epitroclea (ET), la protuberanza ossea che si palpa sul lato mediale del gomito quando si mostrano braccio e avambraccio sulla loro superficie palmare o volare.
Neurolisi del nervo ulnare al gomito Caso di neurolisi di nervo ulnare al gomito. Al termine dell'intervento il nervo ulnare (NU) risulta libero da qualsiasi compressione nel suo canale anatomico naturale, il canale cubitale. Il canale si trova subito posteriormente all'epitroclea (ET), la protuberanza ossea che si palpa sul lato mediale del gomito quando si mostrano braccio e avambraccio sulla loro superficie palmare o volare.
Tunnel carpale
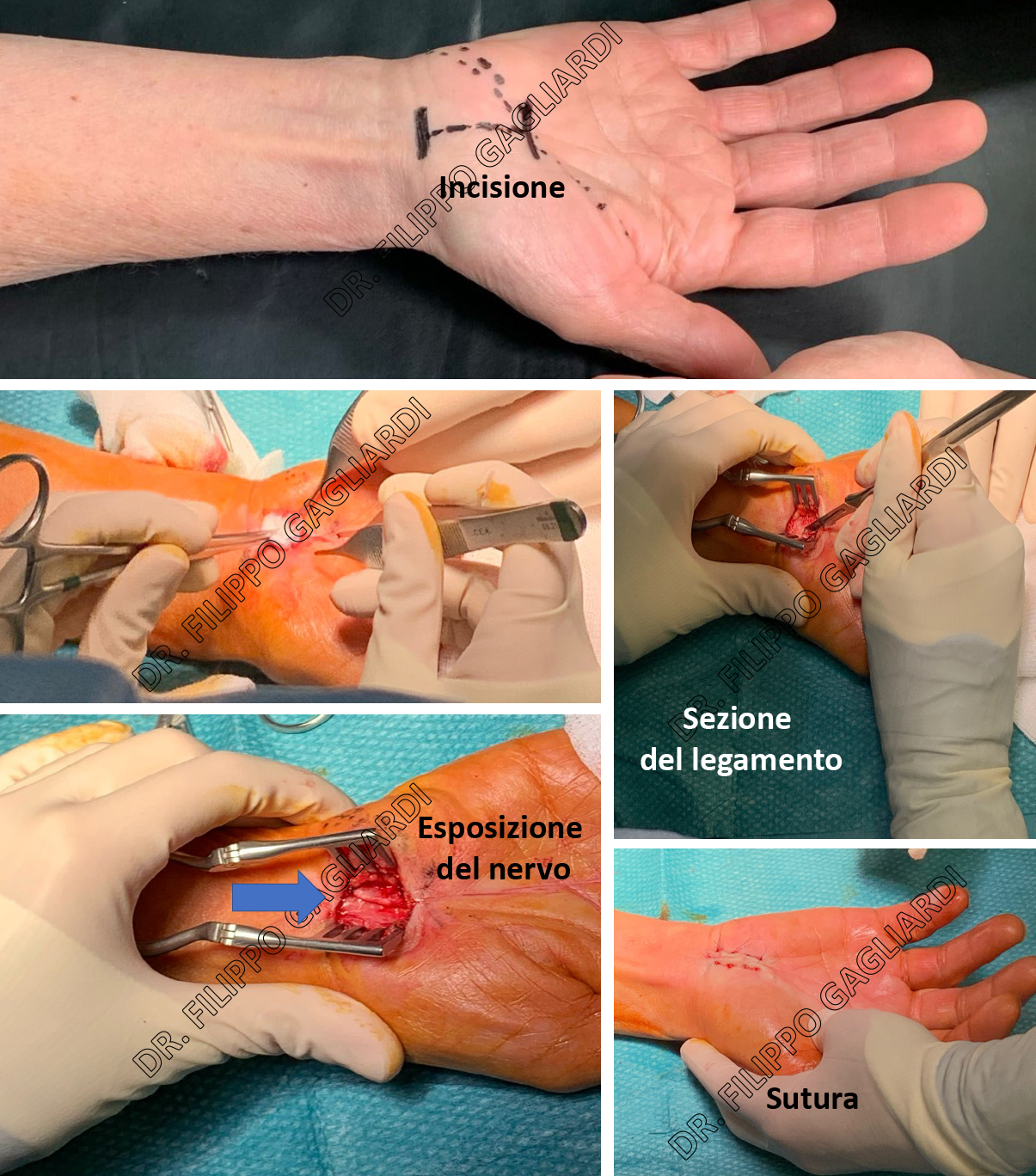
Tunnel carpale. Caso di decompressione del nervo mediano al canale del carpo. Al termine dell'intervento il nervo mediano risulta libero da qualsiasi compressione nel suo canale anatomico naturale. Il canale del carpo si trova in profondità rispetto ad una struttura fibrosa, detta legamento trasverso del carpo, che in determinate condizioni patologiche (sindrome del tunnel carpale) lo può comprimere e deve pertanto essere sezionato per risolvere la sintomatologia dolorosa.
Fratture traumatiche
Le fratture vertebrali traumatiche interessano più frequentemente la popolazione giovane/adulta e sono potenzialmente responsabili di danni anche gravi alle strutture nervose (midollo spinale e radici, nervi) che posso esitare in danni funzionali rilevanti ai pazienti.
Epidemiologia di fratture vertebrali traumatiche
Come detto, la patologia traumatica della colonna interessa soprattutto la popolazione giovane e adulta con prevalenza per il genere maschile. I traumi infatti sono tra le prime cause di disabilità nei giovani paesi del mondo sviluppato. Le fratture vertebrali traumatiche sono classificate in base alla parte di vertebra coinvolta dal trauma. Possono pertanto interessare le componenti posteriori della vertebra come le lamine, i processi spinosi (elementi non indispensabili per la stabilità della colonna), oppure i processi articolari e i peduncoli (fondamentali per l’assetto meccanico) o gli elementi anteriori ovvero il corpo vertebrale, detto soma. Sono state elaborate nel tempo numerose classificazioni delle fratture vertebrali. Attualmente la più in uso è quella della società di chirurgia vertebrale (AO Spine). Secondo tale classificazione le fratture del corpo vertebrale possono condizionare a diverso grado la stabilità del rachide, in base all’interessamento del margine anteriore (muro anteriore)o posteriore (muro posteriore), o dei margini superiori ed inferiori della vertebra (piatti somatici). La situazione più critica si verifica nel caso di fratture a scoppio ovvero quando tutte le parti del corpo vertebrale vengono coinvolte. Il muro posteriore è a stretto contatto con le strutture nervose ed una sua dislocazione può condizionare una compressione del midollo spinale ed esitare in danni neurologici anche gravi. Altra componente che può andare incontro a rottura è l’apparato di legamenti che unisce le vertebre tra di loro, tra essi compreso il disco intervertebrale. La dinamica del trauma è fondamentale nel comprendere la meccanica del danno; il danno da iperflessione si concentra a livello del corpo vertebrale e del sistema di legamenti posteriori, mentre il danno da iperestensione determina fratture degli elementi posteriori con il danno dei legamenti anteriori. Nelle fratture più gravi si possono verificare anche lussazioni delle vertebre tra di loro, ovvero la perdita dei rapporti articolari.
Clinica
I sintomi delle fratture vertebrali traumatiche includono:
- Dolore locale ed irradiato agli superiori ed inferiori
- Difetti di sensibilità fino a veri e propri livelli di insensibilità
- Difetti motori fino alla paralisi completa di gambe e braccia
La compressione del midollo spinale a livello cervicale può portare nei casi più gravi alla tetraplegia (paralisi completa dei 4 arti), e nel caso delle lesioni delle prime vertebre cervicali può alterare la meccanica respiratoria. In caso di compressione del midollo a livello dorsale e lombare si può verificare una paraparesi/paraplegia (paralisi degli arti inferiori) con un vero e proprio livello al di sotto del quale non vi è percezione sensitiva (livello sensitivo) e che corrisponde al livello di compressione.
Diagnosi di fratture vertebrali traumatiche
La diagnosi di fratture traumatiche deve essere estremamente approfondita e viene fatta partendo da una radiografia standard e successivo esame TC per valutare nei dettagli le caratteristiche della frattura. La RM può aiutare a definire il grado di interessamento dei legamenti e nel caso di danno neurologico la sede della compressione.
- RX del rachide. È un esame standard che valuta la presenza della frattura o cedimenti somatici nell’immediato.
- TC del rachide. La TC mirata sul segmento di interesse consente di definire nel dettaglio quali parti della vertebra sono interessate.
- RM del rachide. La risonanza magnetica è l’esame di completamento per la valutazione di una frattura. Essa consente di valutare il grado di interessamento dei legamenti e nel caso di danno danno neurologico la sede della compressione.
Una volta accertata la diagnosi le opzioni terapeutiche sono molteplici.
Terapia
L’approccio terapeutico delle fratture vertebrali traumatiche è multimodale e va valutato caso per caso dallo specialista neurochirurgo. Forme lievi possono giovarsi di un bustino o collare cervicale in base alla sede (ortesi) e alla terapia medica conservativa. I casi più gravi possono necessitare di interventi chirurgici di stabilizzazione vertebrale (artrodesi) per il ripristino della stabilità della colonna e la correzione di eventuali deformità e, laddove ci sia una compressione delle strutture nervose, è fondamentale decomprimere tempestivamente i nervi e il tratto di midollo spinale coinvolto.
Prognosi
La prognosi delle fratture vertebrali traumatiche è condizionata dalla presenza di un danno neurologico. In caso di assenza di sintomatologia neurologica il recupero funzionale di solito è completo con un ritorno alla normalità. Nel caso di danno neurologico è fondamentale la tempestività del trattamento.
Forschungsprojekte.
Dr. Filippo Gagliardi ist aktiv an der Entwicklung klinischer und präklinischer Forschungsprojekte in den folgenden Sektoren beteiligt:
Präklinische Forschungsprojekte
- Suche nach neuen Onkogenen und Biomarkern in der Behandlung von Hirntumoren.
- Molekulare Charakterisierung von Stammzellen aus Krebszellen.
- Entwicklung innovativer Bildungsprotokolle für Hirntumore und radiogenomischen Studien.
Klinische Forschung
- Entwicklung innovativer mikrochirurgischer Techniken für die Behandlung von Hirntumoren.
- Entwicklung neuer Trainingsmodelle in Neurochirurgie.
- Er arbeitet an der Entwicklung von Protokollen und Erprobung neuer Medikamente für die Behandlung von Tumoren des Nervensystems.
- Mitbegründer der Biobank für biologisches Material zur Erforschung von Erkrankungen des Zentralnervensystems.

Dr. Filippo Gagliardi mit Dr. Rossella Galli, Group leader von Neural Stem Cell Biology Unit, Division of Regenerative Medicine, Stem Cells and Gene Therapy del San Raffaele, im Labor während ihre Forshungsaktivität über Stammzellen. Dr. Gagliardi und Dr. Galli arbeiten zusammen über mehrere präklinische Forshungprojeckte über Tumoren des Nervensystems. ![]()
Zwei Typen von Krankenhausaufenthalten
Krankenhausaufenthalte in Absprache mit dem national Gesundheitssystem
Krankenhausaufenthalte in Absprache mit dem nationalen Gesundheitssystem werden in der Neurochirurgischen Abteilung durchgeführt, 2. Stock Sektor Iceberg, Krankenhaus San Raffaele, Via Olgettina 60, Mailand.
Die Indikation zur stationären Aufnahme wird im Rahmen einer ambulanten neurochirurgischen Abklärung gestellt.
Der Patient wird normalerweise eine Woche vor dem vorgesehenen Krankenhausaufenthalt vom Sekretariat der Abteilung für Krankenhausaufenthalte kontaktiert.
Daraufhin wird der Patient aufgefordert am selben Morgen mit dem Aufnahmeantrag, den persönlichen Dokumenten und allen klinischen Unterlagen im Zusammenhang mit dem Krankenhausaufenthalt und eventuellen gesundheitlichen Vorerkrankungen zum zentralen Empfang des Krankenhauses zu gehen.
Nach der behördlichen Aufnahme geht der Patient zur Abteilung Neurochirurgie (2. Stock, Sektor Iceberg).
Hier wird die ärztliche und pflegerische Aufnahme durchgeführt.
Die Entlassungen finden in der Regel innerhalb von 12 Stunden des festgesetzten Tages, mittels eines Entlassungsbriefes mit einem Überblick der durchgeführten therapeutischen und diagnostischen Verfahren.
Krankenhausaufenthalte im Rahmen einer Solvenzregelung
Der Krankenhausaufenthalt wird in einem reinen oder konventionellen Solvenzregelung durchgeführt.
Die Krankenhausaufenthalte im Rahmen einer Solvenzregelung werden in der Solvenzabteilung im 6. Stock, Sektor Iceberg, Krankenhaus San Raffaele, Via Olgettina, 60 20132 Mailand durchgeführt.
Falls die Versicherung nicht an die Institution oder das medizinische Personal vertragsverbunden ist, kann der Patient in Vereinbarung mit der Versicherung einen Aufenthalt mit indirekter Versicherung durchführen.
Die Indikation zum Krankenhausaufenthalt wird im Rahmen einer ambulanten neurochirurgischen Abklärung gestellt.
In diesem Fall muss der Patient ausdrücklich einen Solvenz- Krankenhausaufenthalt beantragen und es wird dazu ein Kostenvoranschlag formuliert.
Mittels der Annahme des Kostenvoranschlages von Seiten des Patienten oder der Versicherung, fährt man mit der Planung des Krankenhausaufenthaltes fort.
Am Tag der Aufnahme muss der Patient zur Annahme der Solventen (Erdgeschoss, Sektor D) gehen. Er muss die Dokumente und die klinischen Unterlagen zum Krankenhausaufenthalt mitbringen.
Nach behördlicher Annahme wird der Patient anschließend in die Solvenzabteilung aufgenommen.
Nach der Spezialisierung in Neurochirurgie hat Dr. Filippo Gagliardi einen Doktortitel in Neurowissenschaften an der Universität Vita-Salute San Raffaele in Mailand mit einem präklinischen Forschnungsprojekt über die molekulare Charakterisierung der Stammzellen aus Glioblastomen erworben.
Aufgrund seiner wissenschaftlichen Tätigkeiten ist er an zahlreichen klinischen und präklinischen Forschungsprotokollen über Hirntumoren beteiligt.
Er ist Mitbegründer der Biobank für Tumore des Nervensystems des Krankenhauses San Raffaele in Mailand.
Im Rahmen der Chirurgie hat er mehrere Forschungsprojekte als „Research Fellow“ an den folgenden Universitäten abgeschlossen:
- An der Abteilung Neurochirurgie der Universität Ludwig Maximilian (München, Deutschland).
- An der Abteilung Neurochirurgie in Georgien Washington University (Washington DC, USA).
Seine Forschungen, die der Entwicklung innovativer Ansätze bei Hirntumoren gerichtet waren, brachten ihm den internationalen „Karl Fellowship Award“ der „World Society of Cranial Base Surgery.“
Er ist Autor von mehr als 80 Veröffentlichungen in internationalen Zeitschriften und hat zahlreiche Kapitel von Neurochrirurgiebüchern geschrieben, die von internationalen Verlagen und Onlinezeitschriften veröffentlicht.
2019 hat Dr. Filippo Gagliardi ein Buch mit dem Titel „Operative cranial neurosurgical anatomy“, das auf der ganzen Welt von einem Amerikanischen Verlag publiziert worden ist.
Auf Einladung und als Experte hat er Konferenzen, Seminare und Kurse an renommierten, nationalen und internationalen Universitäten durchgeführt. Unter den wichtigsten zitieren wir Macquarie University (Sydney, NSW, Australien), George Washington University (Washington DC, USA).

Dr. Filippo Gagliardi in Saint Louis, USA, mit einem Expertenteam aus aller Welt, er war als Mitglied des Wissenschaftlichen Sekretariats, zu einem internationalen Kurs in Neurochirurgie eingeladen.
Wenn Sie auf diesen Link klicken, können Sie ein Interview hören, das Dr. Filippo Gagliardi während eines internationalen Kurses über chirurgische Anatomie an der Universität in Alicante in Spanien abgehalten hat.
Dr. Med. Filippo Gagliardi - Neurochirurg Neurochirurgie und Gamma Knife PhD in Molekularmedizin - Neurowissenschaft Krankenhaus San Raffaele - Mailand
Siringomielia e idromielia
Siringomielia
La siringomielia è una dilatazione del canale ependimale. È un canale di pochi millimetri di diametro che si trova all'interno del midollo spinale ed è connesso al sistema dei ventricoli cerebrali. La dilatazione può essere conseguenza di aumento della sua pressione interna (idromielia) con conseguente sfiancamento delle sue pareti o da una degenerazione del tessuto nervoso intorno ad esso (siringomielia propriamente detta). Alcuni tumori del midollo spinale, generando una compressione delle vie di circolazione liquorale possono indurre un aumento della pressione del canale, generarando una siringomielia secondaria. Altre forme di siringomielia secondaria possono essere causate da quadri malformativi di cervello e midollo spinale (e.g., malformazione di Chiari, meningocele). Si tratta, però, di forme congenite. Il termine siringa, mutuato dal greco, si riferisce appunto a questa cavità piena di liquor che si crea all'interno del midollo spinale. Nei casi più gravi la cavità può estendersi fino al tronco dell'encefalo, la struttura nervosa che connette cervello a midollo spinale. Essa contiene numerose strutture critiche tra cui le vie motorie, sensitive e i centri di funzionamento dei nervi cranici. La progressiva dilatazione del canale ependimale porta ad una progressiva sofferenza delle fibre nervose disposte attorno ad esso. Da un punto di vista clinico, i pazienti con siringomielia lamentano disturbi di sensibilità a livello degli arti superiori: in particolare il deficit coinvolge la sensibilità al calore e al dolore. La perdita di sensibilità si estende anche a livello della sensibilità fine tattile e propriocettiva con una perdita progressiva anche della funzione motoria, in particolare la motilità fine delle mani. Il disturbo tende poi ad irradiarsi anche agli arti inferiori.
RM del midollo spinale
Le tecnica diagnostica fondamentale è la RM del midollo spinale. Essa va eseguita senza e con il mezzo di contrasto per escludere forme secondarie alla presenza di tumori intramidollari. La cavità risulta iperintensa nelle sequenze T2-pesate e, nelle forme primitive, non prende il contrasto. La RM consente di valutare la sede e l'estensione della patologia, diagnosticare eventuali situazioni causali. All'imaging tradizionale si possono affiancare indagini strumentali come i potenziali evocati motori e somaro-sensitivi. Queste indagini valutano lo stato di salute del midollo spinale in termini di efficienza di conduzione. Sono, inoltre, un completamento diagnostico fondamentale anche nelle condizioni di stenosi cervicale e dorsale. La terapia della siringomielia è multimodale. Va innanzitutto curata la causa, se presente una forma secondaria, sia essa un quadro malformativo, compressivo su base degenerativa (ernie cervicali, ernie dorsali, stenosi di canale cervicale e dorsale) o tumorale. Nei casi di siringomielia primaria il trattamento è medico sintomatico. Vengono utilizzati farmaci che riducono i disturbi neuropatici (farmaci neuromodulatori). La chirurgia è riservata per le forme più gravi. Gli interventi proposti di solito sono la fenestrazione della cisti mediante l'apertura della sua parete (mielotomia mediana). Oppure il posizionamento di un tubicino di drenaggio che fa comunicare cisti con spazio liquido intorno al midollo spinale (spazio subaracnoideo) (derivazione della siringa). L'intervento viene effettuato in anestesia generale con un attento monitoraggio neurofisiologico per la preservazione della funzionalità del midollo spinale.
Prognosi
Dipende dalla sua estensione, dai meccanismi causali e dal grado di compromissione funzionale del midollo spinale al momento della chirurgia.
Malformazione di Chiari
La malformazione di Chiari, detta anche sindrome di Arnold Chiari, dal medico che per primo la descrisse, è un quadro malformativo relativamente frequente che coinvolge la base del cranio. Nella malformazione di Chiari le tonsille cerebellari, la componente più caudale del cervelletto, sono più basse rispetto alle condizioni di normalità. Si definisce discesa delle tonsille cerebellari la situazione in cui esse si trovino al di sotto del livello del grande forame occipitale (forame magno), il forame che congiunge la cavità cranica al canale vertebrale e dà passaggio al midollo spinale. La gravità dipende dall'entità della discesa delle tonsille cerebrali.
Malformazione di Chiari
La malformazione di Chiari può associarsi a quadri malformativi complessi tra cui la platibasia (conformazione appiattita della base del cranio). Una delle cause riconosciute è il midollo fissato, o midollo ancorato, o tethered cord, condizione in cui la presenza di un legamento ispessito, il filum terminale, e più corto del normale e tiene ancorato basso il midollo spinale. La trazione verso il basso del midollo condiziona la posizione abbassata delle tonsille cerebellari al di sotto del forame magno. Nelle condizioni più gravi il passaggio delle tonsille cerebellari nel forame genera una compressione del tronco dell'encefalo, in particolare del bulbo spinale, che normalmente è situato in questa posizione. La conseguente compressione delle vie di deflusso liquorale può determinare la dilatazione dei ventricoli cerebrali (idrocefalo) e del canale ependimale (siringomielia). I pazienti con malformazione di Chiari possono avere diversi gradi di compromissione neurologica. Nelle forme più lievi il riscontro è incidentale durante l'esecuzione di un esame RM di routine per altri motivi. Nelle forme più gravi possono sviluppare progressivi deficit dei nervi cranici misti, che presiedono alle attività di deglutizione e fonazione, e.g., variazioni del tono della voce (disfonia), disfagia (fatica a deglutire e mandare giù il cibo). Il coinvolgimento del midollo spinale può generare disturbi motori e sensitivi progressivi ai 4 arti. Sintomo spesso presente è la cefalea con caratteristiche muscolo-tensive e la cefalea da premito. La cefalea muscolo-tensiva si concentra a livello del collo, e si irradia classicamente nella ragione orbitaria e frontale; è generata da una contrattura della muscolatura paravertebrale cervicale. La cefalea da premito invece è s è caratterizzata da accessi di cefalea connessi con sforzi a glottide chiusa (e.g., sollevamento di un peso, colpo di tosse, manovre di ponzamento).
Tecnica diagnostica Terapia
La tecnica diagnostica elettiva per la malformazione di Chiari è la RM dell'encefalo. Il quadro di RM documenta la discesa delle tonsille cerebellari. Nei casi più gravi si evidenzia una compressione del tronco dell'encefalo e idrocefalo. É necessario sempre indagare anche il rachide lombare per escludere un quadro di ancoraggio midollare.
Terapia
La terapia è primariamente medica e fisico-riabilitata per ridurre la cefalea. La chirurgia va considerata solo nei quadri più gravi con alterazioni neurologiche. L'intervento correttivo è detto di decompressione del forame magno. Prevede l'apertura del grande forame occipitale e la plastica della dura madre. La plastica è una plastica in allargamento. Consente di ridurre la pressione sulle strutture nervose e al liquor di tornare a circolare liberamente. La chirurgia viene eseguita in anestesia generale con una incisione posteriore a livello della nuca. É fondamentale un'attenta valutazione di rischi e benefici prima di proporre l'intervento chirurgico. Si ricorda che tale procedimento é da riservarsi solo ai casi più gravi. Ad ogni modo la prognosi dei pazienti con malformazione di Chiari è generalmente buona con una remissione della sintomatologia neurologica dopo l'intervento.
Fratture da osteoporosi
Le fratture porotiche sono fratture vertebrali secondarie all’osteoporosi. Colpiscono soprattutto le donne nel periodo successivo alla menopausa. L’osteoporosi può anche dipendere dall’uso prolungato di cortisone.
Epidemiologia
L’osteoporosi è una patologia estremamente diffusa nella popolazione generale, in particolare nelle donne nel periodo successivo alla menopausa. Questo è dovuto ad un cambiamento dell’assetto ormonale che induce una variazione del metabolismo dell'osso. L’osso va incontro ad una progressiva demineralizzazione con l’impoverimento di parte della sua componente strutturale (osso spongioso) e sottoposto a carichi banali può cedere e rompersi.
Fratture-da-osteoporosi
Classicamente le fratture da osteoporosi si localizzano a livello del corpo vertebrale (dette fratture somatiche) che è la parte della vertebra che sostiene la maggiore sollecitazione meccanica. La vertebra tende pertanto ad assumere una forma di cuneo (cuneizzazione), poiché spesso la sua componente più anteriore (muro anteriore) subisce una riduzione di altezza superiore alla sua componente posteriore (muro posteriore), quindi vista lateralmente la vertebra assomiglia ad un cuneo. Questa situazione induce una deformità della normale curvatura della colonna vertebrale (cifotizzazione), che essa stessa è causa di dolore. Nei casi più gravi la vertebra può schiacciarsi a tal punto da diventare un a vertebra piatta, detta vertebra plana.
Clinica
I sintomi della frattura vertebrale da osteoporosi includono:
- Dolore locale al rachide ed irradiato agli arti inferiori/superiori
- Deficit sensitivo agli arti inferiori/superiori
- Deficit motorio agli arti inferiori/superiori
La frattura da osteoporosi si manifesta con un dolore intenso e acuto a livello della vertebra fratturata, che può condizionare, se non trattato adeguatamente, una situazione di dolore cronico. Talvolta il dolore può irradiarsi alle braccia (nel caso di fratture dorsali) o ai fianchi nel caso di fratture lombari. Poco frequenti sono le fratture cervicali, poiché il, collo sopporta un minor carico rispetto ai segmenti inferiori della colonna. Il dolore generalmente compare dopo uno sforzo fisico anche banale o un trauma minore.
Diagnosi
La diagnosi di frattura da osteoporosi viene fatta con la radiografia standard e successivo esame TC per valutare nei dettagli le caratteristiche della frattura. La RM può aiutare a definire il grado di interessamento infiammatorio dell’osso (iperintensità in STIR) che può essere importante nella successiva pianificazione terapeutica. È fondamentale definire inoltre il grado di mineralizzazione dell’osso e questo viene fatto con una MOC (mineralometria ossea).
- RX del rachide. È un esame standard che valuta la presenza della frattura o cedimenti somatici nell’immediato. Difficilmente è in grado di datare la frattura.
- TC del rachide. La TC mirata sul segmento di interesse consente di datare la frattura (recente o cronicizzata) e di definire nel dettaglio quali parti della vertebra sono interessate.
- RM del rachide. La risonanza magnetica è l’esame di completamento per la valutazione di una frattura da osteoporosi. Essa consente di valutare lo stato di infiammazione dell’osso o fratture non altrimenti identificate con gli esami precedenti.
- MOC. La mineralometria ossea, permette di valutare il grado di mineralizzazione dell’osso e graduare la gravità dell’osteoporosi/osteopenia.
Una volta accertata la diagnosi di frattura da osteoporosi le opzioni terapeutiche sono molteplici.
Terapia per fratture da osteoporosi
L’approccio terapeutico alle fratture vertebrali da osteoporosi è multimodale e va valutato caso per caso dallo specialista neurochirurgo. Forme lievi possono giovarsi di riposo, posizionamento di un bustino (ortesi) e terapia medica conservativa. Ulteriori alternative sono le infiltrazioni. La terapia medica si avvale dell'utilizzo di anti-infiammatori, miorilassanti e farmaci per il reintegro minerale (ad esempio alendronati) che devono essere prescritti da uno specialista delle malattie metaboliche dell’osso nell’ottica di un approccio integrato e multidisciplinare con il neurochirurgo. I farmaci per la terapia del dolore devono invece essere necessariamente prescritti dallo specialista neurochirurgo, dopo un’attenta valutazione del caso. Alla terapia medica generalmente si associa l'utilizzo di un'ortesi (busto). Anche in questo caso l'indicazione al suo utilizzo e la selezione del dispositivo più adatto viene data dallo specialista neurochirurgo. Le infiltrazioni peridurali, cosi come le infiltrazioni di punti trigger (punti grilletto che scatenano il dolore), dei processi articolari, le infiltrazioni peri-radicolari o foraminali sono tutti approcci da considerare. Il Dr. Gagliardi ha esperienza in merito anche a queste tecniche, avendo frequentato corsi specifici all'estero. L'approccio della terapia del dolore (approccio palliativo) è da considerarsi nel caso di pazienti anziani con tante patologie (comorbidità). Essa include l'utilizzo di un approccio farmacologico dedicato. Anche in questo caso l'indicazione va data dallo specialista neurochirurgo. I casi più gravi di frattura da osteoporosi possono necessitare di interventi percutanei di vertebroplastica o cifoplastica e in casi estremi di interventi chirurgici di stabilizzazione vertebrale (artrodesi) per il ripristino della stabilità della colonna e la correzione di eventuali deformità.
Prognosi
Le fratture porotiche hanno generalmente una prognosi buona, ovvero vengono trattate efficacemente dalle terapie ad oggi disponibili. È raro che inducano dei danni neurologici maggiori. Tuttavia è necessario selezionare l'approccio terapeutico più adeguato che deve tenere necessariamente in conto non solo le caratteristiche della patologia, ma soprattutto le caratteristiche del paziente. In particolare è fondamentale impostare una terapia del dolore mirata e assicurare il supporto meccanico adeguato alla colonna vertebrale. Il consiglio è di rivolgersi a neurochirurghi e centri specializzati.
Come si fa l'artrodesi
Anestesia
L’artrodesi è un intervento che si esegue in anestesia generale. Sinonimi sono stabilizzazione vertebrale, fissazione vertebrale.
Procedura
La durata dell'artrodesi è variabile e dipende per lo più dal tipo di patologia da trattare. Il paziente viene posizionato prono. Si pratica un’incisione chirurgica lineare centrata sul livello spinale da operare. Il livello viene stabilito con un RX che viene eseguito quando il paziente è già addormentato. Si scollano i muscoli paravertebrali per esporre la parte posteriore delle vertebre dei segmenti di interesse (e.g., lamine, processi spinosi e processi articolari). Con l'ausilio di seriati controlli radiologici si posizionano le viti a livello dei peduncoli delle vertebre di interesse. Nel caso in cui sia necessaria una decompressione delle strutture nervose, si posiziona il microscopio operatorio e si procede in tal senso. A questo punto per pazienti che richiedano una chirurgia discale con posizionamento di cages (gabbiette) nello spazio discale (tecnica TLIF, PLIF) si svuota il disco intervertebrale e si posizionano le gabbie. Le viti sono costituite da una parte filettata e da una testa detto calice, dove viene alloggiata la barra che connette, longitudinalmente, le viti dello stesso lato. Si crea, così, la struttura portante dell’impianto. Le barre vengono sagomate secondo le necessità anatomiche. Quindi si posizionano frammenti ossei (autologhi o eterologhi) a livello delle rime articolari coinvolte dall’impianto previa loro cruentazione per favorire la fusione dei processi articolari (detta artrodesi). Si esegue un controllo radiologico finale per verificare il corretto posizionamento degli impianti. Si chiude la ferita a strati e si lascia in sede uno o due drenaggi sotto la fascia muscolare, che viene rimosso dopo 24 ore. Generalmente si pratica una medicazione a piatto.
Decorso post-operatorio
Dopo l’intervento di artrodesi il paziente viene ricondotto in reparto per la successiva degenza. Nelle prime 24-48 ore si imposta un adeguato piano di terapia antalgica. In prima giornata il paziente viene mobilizzato e messo in piedi con un bustino. Si rimuove il catetere vescicale e i drenaggi e vengono ridotti allo stretto necessario gli accessi venosi. La ferita viene medicata con regolarità. La successiva degenza ha una durata variabile, mediamente di 4-5 gg.
Convalescenza
La convalescenza a casa, laddove non ci siano problematiche cliniche e neurologiche è di circa un mese. Il questo periodo il paziente conduce una vita normale, astenendosi da sforzi fisici, attività sportiva e indossando il bustino quando si mobilizza. I farmaci con cui viene dimesso sono di solito l’eparina (somministrazione sottocutanea), che viene mantenuta per i primi 10-15 gg, e anti-dolorifici/miorilassanti. In sede di ferita si lascia un cerotto fino alla rimozione dei punti di sutura, che di solito avviene dopo 8-10 gg dall’artrodesi. Il controllo post-operatorio di solito avviene dopo 30 giorni, previa esecuzione di una RX centrata sul livello vertebrale sottoposto ad artrodesi che permette di valutare gli esiti dell'intervento. Il neurochirurgo decide in tale sede se e come rimuovere il bustino.
Laminectomia e recalibrage
Anestesia
La laminectomia, cosi come il recalibrage, è un intervento che si esegue in anestesia generale.
Procedura di laminectomia e recalibrage
La durata dell'intervento è variabile a causa del numero di livelli vertebrali da trattare. Il paziente viene posizionato prono. Si pratica un’incisione chirurgica lineare centrata sul livello spinale da operare. Il livello viene stabilito con un RX che viene eseguito quando il paziente è già addormentato. Si scollano i muscoli paravertebrali per esporre la parte posteriore delle vertebre del segmento di interesse (e.g., lamine, processi spinosi, processi articolari). Viene posizionato il microscopio operatorio per asportare componenti ossee (processi articolari ipertrofici) e legamentose (legamento giallo ipertrofico) che generano la compressione. Al termine della procedura si esplora il nervo (neurolisi) ed eventualmente si allarga il foro di uscita del nervo dal canale vertebrale (foraminotomia). Si chiude la ferita a strati e si lascia in sede un drenaggio sotto la fascia muscolare, che viene rimosso dopo 24 ore. Generalmente si pratica una medicazione a piatto.
Decorso post-operatorio
Dopo l’intervento il paziente viene ricondotto in reparto per la successiva degenza. Nelle prime 24-48 ore si imposta un adeguato piano di terapia antalgica. In prima giornata il paziente viene mobilizzato e messo in piedi con un bustino. Si rimuovono il catetere vescicale e i drenaggi e vengono ridotti allo stretto necessario gli accessi venosi. La ferita viene medicata con regolarità. La successiva degenza ha una durata variabile, mediamente di 2-3 gg.
Convalescenza
La convalescenza a casa, laddove non ci siano problematiche cliniche e neurologiche è di circa un mese, durante il quale il paziente conduce una vita normale, astenendosi da sforzi fisici, attività sportiva, e indossando il bustino quando si mobilizza. I farmaci con cui il paziente viene dimesso sono di solito l’eparina (somministrazione sottocutanea), che viene mantenuta per i primi 10-15 gg, e anti-dolorifici/miorilassanti. In sede di ferita si lascia un cerotto fino alla rimozione dei punti di sutura, che di solito avviene dopo 8-10 gg dall’intervento. Il controllo post-operatorio di solito avviene dopo 30 giorni. Si decide in tale sede se e come rimuovere il bustino.
Erniectomia, microdiscectomia lombare
Anestesia
La erniectomia/microdiscectomia lombare è un intervento che si esegue in anestesia generale.
Procedura di erniectomia/microdiscectomia lombare
La durata dell'intervento è variabile, in genere da una a due ore. Il paziente viene posizionato prono. Di seguito si pratica un’incisione chirurgica lineare di circa 5 cm centrata sul livello spinale da operare. Il livello viene stabilito con un RX che viene eseguito quando il paziente è già addormentato. Si scollano i muscoli paravertebrali per esporre la parte posteriore delle vertebre del segmento di interesse in particolare lo spazio inter-laminare (tra le lamine). Durante l' erniectomia/microdiscectomia lombare viene posizionato il microscopio operatorio. Si identificano l'ernia e il nervo compresso. Si procede con delicatezza all'asportazione dell'ernia con strumenti microchirurgici. Se indicato si svuota parzialmente il disco intervertebrale. Al termine della procedura si esplora il nervo (neurolisi) ed eventualmente si allarga il forame di uscita del nervo dal canale vertebrale (foraminotomia). Si chiude la ferita a strati. Generalmente si pratica una medicazione a piatto.
Decorso post-operatorio
Dopo l’intervento di erniectomia/microdiscectomia lombare il paziente viene ricondotto in reparto per la successiva degenza. In prima giornata il paziente viene mobilizzato e messo in piedi con un bustino semirigido. Si rimuove il drenaggio e vengono ridotti allo stretto necessario gli accessi venosi. La ferita viene medicata con regolarità. La successiva degenza ha una durata variabile, mediamente di 1-2 gg.
Convalescenza
La convalescenza a casa, laddove non ci siano problematiche cliniche e neurologiche, è di circa un mese, durante il quale il paziente conduce una vita normale, astenendosi da sforzi fisici, attività sportiva, e indossando il bustino quando si mobilizza. I farmaci con cui il paziente viene dimesso sono di solito l’eparina (somministrazione sottocutanea), che viene mantenuta per i primi 10-15 gg,, anti-dolorifici/miorilassanti e, quando indicato, cortisone e farmaci neuromodulatori. In sede di ferita si lascia un cerotto. La sutura di solito è intradermica e non richiede rimozione. Il controllo post-operatorio di solito avviene dopo 30 giorni. Si decide in tale sede se e come rimuovere il bustino.
Derivazione ventricolare
Anestesia
La derivazione ventricolare (ventricolo-peritoneale o ventricolo-striale) è un intervento che si esegue in anestesia generale.
Procedura di derivazione ventricolare
La durata dell'intervento di derivazione ventricolare è variabile, in genere varia tra una e due ore. Il paziente viene posizionato supino. Nella derivazione ventricolare si pratica una piccola incisione a livello del capo dietro l'attaccatura dei capelli. In sintesi si pratica un piccolo foro nella teca cranica e si posiziona un catetere all'interno del sistema ventricolare. Il catetere ventricolare viene collegato ad una valvola telemetrica (programmabile dall'esterno) che viene settata su una determinata pressione di apertura in base alla pressione intracranica che si vuole mentenere perchè varia da caso a caso. Catetere ventricolare e valvola vengono connesse ad un catetere distale che viene tunnellizzato sotto la pelle a livello del collo, torace ed addome attraverso piccole incisioni cutanee lungo il loro decorso. Si pratica, infine, una piccola incisione para-ombelicale. Si accede alla cavità peritoneale all'interno della quale si inserisce il catetere distale. Nella tecnica della derivazione ventricolo-atriale, il catetere distale invece che in addome viene posizionato attraverso una piccola incisione sovra-claveare all'interno della vena cava superiore nell'atrio del cuore. Indicazioni all'una o all'altra procedura vengono valutate di caso in caso.
Decorso post-operatorio
Dopo l’intervento di derivazione ventricolare il paziente viene ricondotto in reparto per la successiva degenza. In prima giornata il paziente viene mobilizzato e messo in piedi. Si rimuove il catetere vescicale e vengono ridotti allo stretto necessario gli accessi venosi. Le ferite vengono medicate con regolarità. La successiva degenza ha una durata variabile, mediamente di 3-4 gg.
Convalescenza
La convalescenza a casa, laddove non ci siano problematiche cliniche e neurologiche, è di circa un mese, durante il quale il paziente conduce una vita normale, astenendosi da sforzi fisici. I farmaci con cui il paziente viene dimesso sono di solito l’eparina (somministrazione sottocutanea), che viene mantenuta per i primi 10-15 gg, e anti-dolorifici. In sede di ferita si lascia un cerotto. I punti di sutura vengono rimossi in 8-10 giornata dopo la chirurgia. Il controllo post-operatorio di solito avviene dopo 30 giorni, previa esecuzione di una TC encefalo che permette di valutare l'entità del drenaggio ventricolare.
Vertebroplastica e cifoplastica
Anestesia
La vertebroplastica e cifoplastica vengono eseguite preferibilmente in regime di anestesia generale.
Procedura
Vertebroplastica e cifoplastica sono delle procedure spinali mini-invasive che prevedono l’iniezione di una sostanza cementante (metilmetacrilato) all’interno del corpo vertebrale (soma) attraverso degli aghi dedicati (trocar). Sono procedure mini-invasive percutanee, ovvero non richiedono l’incisione della cute. La cifoplastica oltre all’iniezione di cemento prevede anche il rimodellamento del corpo vertebrale, quando questo sia deformato in seguito alla frattura (cuneizzato).
Vertebroplastica e cifoplastica
Il rimodellamento vertebrale si ottiene mediante l’inserimento di un palloncino dedicato attraverso l’accesso percutaneo, che viene fatto espandere sotto pressione controllata all’interno del corpo vertebrale così da ottenere la riespansione dello stesso. È una procedura che deve essere necessariamente eseguita poche ore/giorni dopo l’evento fratturativo altrimenti risulta inefficace.
Sulla base di questo razionale sono state elaborate tecniche alternative che prevedono l’utilizzo di veri e propri micro-espansori metallici (spine jack), reti metalliche espandibili di contenimento del cemento (stent vertebrali).
Lo scopo di queste procedure è di restituire alla vertebra una morfologia adeguata a supportare il carico e fornirle resistenza meccanica, al fine di evitare deformità di maggiore entità.
Le indicazioni più comuni sono rappresentate dalle fratture vertebrali da osteoporosi (crolli vertebrali) e dalle fratture patologiche indotte ad esempio da metastasi vertebrali. I margini di applicazione sono definiti e vanno attentamente valutati da specialisti di chirurgia vertebrale.
Decorso post-operatorio
In prima giornata dall'intervento generalmente il paziente viene mobilizzato. La successiva degenza ospedaliera è di solito di 1-2 gg. Si prevede un controllo a distanza di 30-45 gg mediante un RX mirato sulla sede di intervento.
Convalescenza
La convalescenza a casa, laddove non ci siano problematiche cliniche e neurologiche è di circa un mese, durante il quale il paziente conduce una vita normale, astenendosi da sforzi fisici, attività sportiva, possibilmente dalla guida. I farmaci con cui viene dimesso sono di solito l’eparina (somministrazione sottocutanea) che viene mantenuta per i primi 10-15 gg. In sede di accesso percutaneo si lascia un cerotto, che viene rimosso nei giorni successivi. Nell'immagine un caso di vertebroplastica eseguita dal Dr. Gagliardi. Si possono vedere gli aghi (trocar) in sede (in basso a sinistra), la fase di iniezione del cemento (in alto) e il risultato radiologico del cemento (sostanza scura) che riempie completamente il corpo della vertebra (in basso a destra). 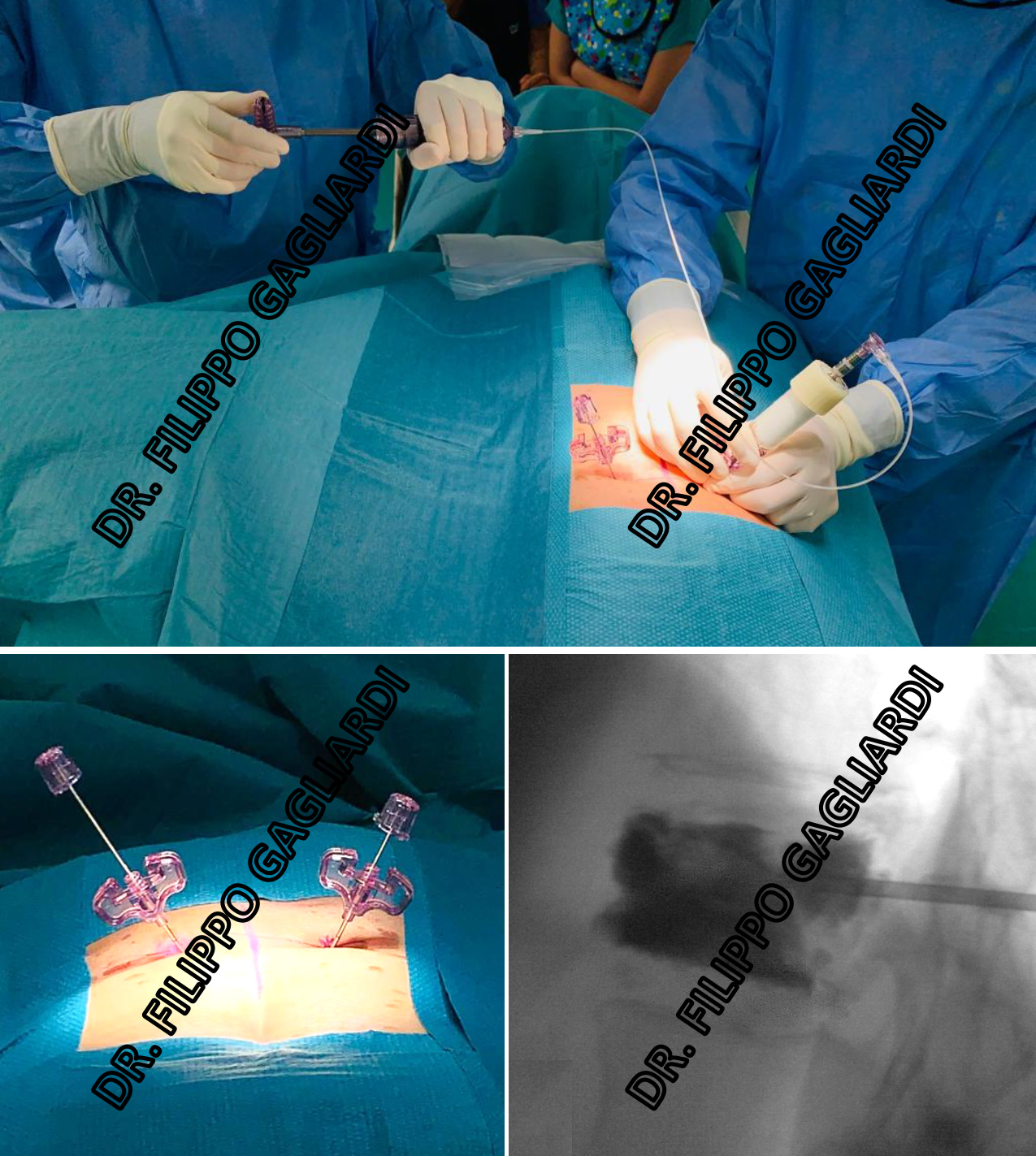 Vertebroplastica e cifoplastica
Vertebroplastica e cifoplastica
Prenota da casa un consulto a distanza con il servizio di Telemedicina
Cari Pazienti, ricevendo richieste di consulto da tutta Italia, per chi fosse impossibilitato a raggiungermi, ho pensato potesse essere utile un servizio di Telemedicina. Premetto che preferisco vedere i Pazienti in ambulatorio per conoscerli personalmente e parlare con loro. Se non vi fosse possibile recarvi in visita, per distanza o per motivi di salute, potete accedere da casa alla piattaforma Telemedicina del San Raffaele e chiedere una valutazione da remoto. Per prenotare un Consulto Medico Neurochirurgico con me, potete farlo direttamente dalla piattaforma iscrivendovi al portale: ospedalesanraffaele.welcomedicine.it 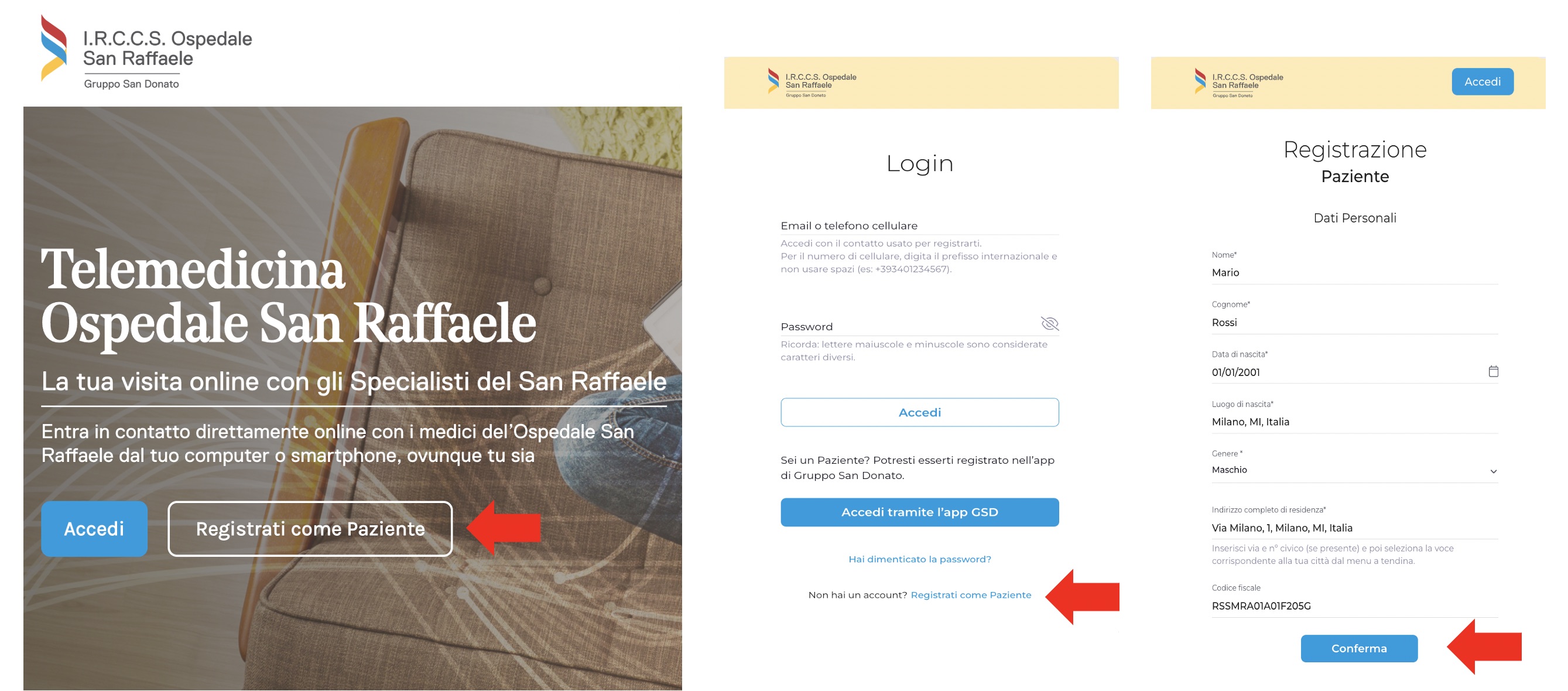 servizio di Telemedicina Ospedale San Raffaele Milano In alternativa potete chiamare il numero 02 2643 8100, premendo il tasto 3 alla voce “Assistenza e Diagnostica Domiciliare” e parlare con l’operatore. A causa dei numerosi impegni clinici e chirurgici, se vi fosse possibile, prenotate una “Televisita asincrona” (Teleconsulto). In questo modo la richiesta verrá evasa nel primo momento libero dagli impegni clinici. Caricate a sistema immagini e referti degli ultimi esami eseguiti e aggiungete una breve descrizione della vostra situazione clinica. Vi ringrazio come sempre per la fiducia. Filippo Gagliardi
servizio di Telemedicina Ospedale San Raffaele Milano In alternativa potete chiamare il numero 02 2643 8100, premendo il tasto 3 alla voce “Assistenza e Diagnostica Domiciliare” e parlare con l’operatore. A causa dei numerosi impegni clinici e chirurgici, se vi fosse possibile, prenotate una “Televisita asincrona” (Teleconsulto). In questo modo la richiesta verrá evasa nel primo momento libero dagli impegni clinici. Caricate a sistema immagini e referti degli ultimi esami eseguiti e aggiungete una breve descrizione della vostra situazione clinica. Vi ringrazio come sempre per la fiducia. Filippo Gagliardi
Tumori primitivi rari del sistema nervoso centrale
In sintesi una lista di tumori primitivi rari del sistema nervoso centrale
Medulloblastomi
I medulloblastomi sono tumori disembrioplastici neuroepiteliali (DNET) maligni , tipici della età infantile con caratteristica localizzazione a livello del cervelletto (fossa cranica posteriore). Dei DNET fanno parte anche i neuroblastomi, retinoblastomi, pinealoblastomi, ependimoblastomi, medullo-epiteliomi. I medulloblastomi hanno una tendenza alla disseminazione all'interno del sistema nervoso centrale nelle vie liquorali (30% dei casi). Il tasso di sopravvivenza a 5 anni è alto e raggiunge il 70% dei casi, grazie all'evoluzione delle moderne tecniche terapeutiche. La cura è la chirurgia seguita dalle terapie adiuvanti (radioterapia e chemioterapia). I fattori prognostici più rilevanti sono l'estensione della chirurgia, l'età del paziente e la presenza di disseminazione liquorale. Nel caso di disseminazione liquorale è indicata la radioterapia su tutto il nevrasse (radioterapia cranio-spinale).
Neurocitomi
Sono tumori che crescono caratteristicamente all'interno dei ventricoli cerebrali (tumori intraventricolari). I neurocitomi sono tipici dei pazienti giovani (II-III decade di vita). Spesso sono presenti calcificazioni. Possono causare idrocefalo ostruttivo. La cura è chirurgica o radiochirurgica. La prognosi è buona.
Tumori della regione pineale
I tumori della regione pineale (ghiandola pineale) più frequenti sono i pinealocitomi (benigni) e i pinealoblastomi (maligni). Le forme maligne possono associarsi a disseminazione liquorale nel 20% dei casi. La chirurgia è al terapia di scelta, seguita, nelle istologie maligne, da radioterapia e chemioterapia. La sopravvivenza varia in base all'istologia. Nelle forme benigne supera il 70% a 5 anni con buone possibilità di guarigione. Accanto ai tumori propri della ghiandola pineale vi sono i tumori a cellule germinali. Sono tumori estremamente radiosensibili (rispondono bene alla radioterapia) e alla chemioterapia, quando indicata. I tassi di sopravvivenza sono molto buoni e superano il 70% dei casi a 10 anni.
Tumori misti glio-neuronali
I tumori a componente mista glio-neuronale sono i gangliogliomi, i gangliocitomi. Tipici della giovane età. Sono spesso causa di crisi epilettiche. La terapia è la chirurgia. La prognosi è buona con ottime possibilità di guarigione. Ci possono tuttavia essere delle forme maligne (forme anaplastiche) in cui è indicata la radioterapia adiuvante e la prognosi può essere meno positiva.
Tumori dei plessi corioidei
Sono tumori che originano dai plessi corioidei dei ventricoli cerebrali. Sono tumori estremamente rari. Tra questi i più frequenti sono i papillomi (benigni); possono causare idrocefalo aresorptivo (da deficit di riassorbimento). La cura è chirurgica e la prognosi molto buona. Diverso è il discorso per le forme maligne (carcinoma dei plessi corioidei). La chirurgia in questi casi deve essere necessariamente affiancata da chemioterapia e radioterapia adiuvante.
Cordomi e condrosarcomi
Sono tumori che originano da residui embrionari della notocorda, una struttura che dà origine nell'età adulta alla parte centrale dei dischi intervertebrali (nucleo polposo). Sono tumori maligni, localmente aggressivi, con alto tasso di recidiva. Le localizzazioni più frequenti sono la base del cranio (clivus) e l'osso sacro. La terapia è la chirurgia, seguita da radioterapia adiuvante.
Lesioni pseudo-tumorali
Le lesioni pseudotumorali comprendono le cisti dermoidi, epidermoidi, le cisti aracnoidee, cisti colloidi, cisti neuroepiteliali e cisti neurenteriche. Sono lesioni cistiche di origine disembriogenetica costituite da tessuti maturi e differenziati. La terapia, quando indicata, è chirurgica. La prognosi è buona.
Erniectomia, microdiscectomia cervicale
Anestesia
La erniectomia/microdiscectomia cervicale è un intervento che si esegue in anestesia generale.
Procedura di erniectomia/microdiscectomia cervicale
La durata dell'intervento è variabile, in genere varia tra una e due ore. Il paziente viene posizionato supino con il capo lievemente esteso. Si pratica un’incisione chirurgica lineare paramediana sinistra di circa 4 cm a livello del collo, centrata sul livello spinale da operare. Il livello viene stabilito con un RX che viene eseguito quando il paziente è già addormentato. Si sfrutta un corridoio chirurgico che corre lateralmente a trachea ed esofago e mediamente al fascio cascolo-nervoso del collo (arteria carotide, vena giugulare e nervo vago). É un corridoio anatomico naturale. Raggiunto per via smussa il piano vertebrale si verifica il corretto livello vertebrale. Si posiziona il microscopio operatorio. Si svuota il disco intervertebrale fino a rimuovere l'ernia e a decomprimere radice nervosa e midollo spinale. Terminata la procedura si inserisce un gabbietta (cage) in sostituzione del disco asportato sotto guida radiologica. Si chiude la ferita a strati lasciando un piccolo drenaggio. Generalmente si pratica una medicazione a piatto.
Decorso post-operatorio
Dopo l’intervento il paziente viene ricondotto in reparto per la successiva degenza. In prima giornata il paziente viene mobilizzato e messo in piedi con un collare cervicale. Si rimuovono il drenaggio, il sondino naso-gastrico e il catetere vescicale e vengono ridotti allo stretto necessario gli accessi venosi. La ferita viene medicata con regolarità. La successiva degenza ha una durata variabile, mediamente di 2-3 gg.
Convalescenza
La convalescenza a casa, laddove non ci siano problematiche cliniche e neurologiche, è di circa un mese, durante il quale il paziente conduce una vita normale, astenendosi da sforzi fisici, attività sportiva, e indossando il collare cervicale. I farmaci con cui il paziente viene dimesso sono di solito l’eparina (somministrazione sottocutanea), che viene mantenuta per i primi 10-15 gg,, anti-dolorifici/miorilassanti e, laddove indicato, anche il cortisone e farmaci neuromodulatori. In sede di ferita si lascia un cerotto. La sutura di solito è intradermica e non richiede rimozione. Il controllo post-operatorio di solito avviene dopo 30 giorni, previa esecuzione di una RX cervicale che permette di valutare gli esiti dell'intervento. Si decide in tale sede se e come rimuovere il collare.
Biopsia stereotassica
Anestesia
La biopsia stereotassica è un intervento che si esegue in anestesia locale
Procedura
La durata della biopsia stereotassica è di poco meno di un'ora. Al paziente viene posizionato una casco di Leksell (casco stereotassico) che viene fissato al capo con 4 piccole viti sulla superficie della cute. Punti nei quali vengono preventivamente eseguiti 4 pomfi di anestesia locale. Il casco rappresenta il sistema cartesiano di riferimento per individuare con precisione quasi assoluta un qualsiasi target all'interno della testa. Con il casco il paziente si sottopone ad una RM encefalo con e senza mezzo di contrasto. Sulla base delle immagini acquisite con il sistema di riferimento cartesiano del casco (asse X, Y, Z) si procede all'elaborazione di un planning utilizzando un software dedicato. Il planning deve prevedere la possibilità di campionare il target percorrendo la via chirurgica più breve e sicura. Una volta ultimato il piano si inizia la procedura in sala operatoria. Il paziente viene posizionato supino. Si pratica un’incisione chirurgica lineare di pochi centimetri a livello dell'entrypoint (che varia di caso in caso). A seguire si pratica un foro nella teca cranica e si apre la dura madre. Si inserisce, utilizzando il sistema stereotassico (arco stereotassico), un ago sottile, detto ago di Sedane, fino al punto target. L'ago è provvisto di un apertura attraverso la quale si carota il bersaglio. Una volta completati i prelievi si estrae l'ago e si chiude la ferita a strati. Si rimuove il casco e, generalmente, si pratica una medicazione a piatto.
Decorso post-operatorio
Dopo la biopsia stereotassica il paziente viene ricondotto in reparto per la successiva degenza. In prima giornata il paziente viene mobilizzato e messo in piedi. Vengono ridotti allo stretto necessario gli accessi venosi. La ferita viene medicata con regolarità. La successiva degenza ha una durata variabile, mediamente di 2-3 gg.
Convalescenza
La convalescenza a casa, laddove non ci siano problematiche cliniche e neurologiche, è di circa un mese, durante il quale il paziente conduce una vita normale, astenendosi da sforzi fisici. I farmaci con cui viene dimesso sono di solito l’eparina (somministrazione sottocutanea), che viene mantenuta per i primi 10-15 gg, anti-dolorifici e, se indicato, cortisone. In sede di ferita si lascia un cerotto fino alla rimozione dei punti di sutura, che di solito avviene dopo 8-10 gg dall’intervento. Il controllo post-operatorio di solito avviene dopo 30 giorni, previa esecuzione di una TC encefalo che permette di valutare gli esiti dell'intervento.
Gli adenomi ipofisari sono tumori benigni della ghiandola ipofisaria. Rappresentano circa il 7% delle lesioni primitive del sistema nervoso centrale. Possono essere classificati in base al profilo di secrezione ormonale in GH-secernenti, TSH-secernenti, ACTH-secernenti, PRL-secernenti (o prolattinomi) e non-secernenti. Clinicamente, gli adenomi ipofisari non secernenti costituiscono circa la metà degli adenomi ipofisari. La maggior parte di essi sono benigni.
Clinica
I sintomi più comuni sono legati alla presenza della massa tumorale (effetto massa) e alle complicanze ormonali (iperproduzione ormonale o insufficienza funzionale della ghiandola). Gli adenomi non-secernenti danno segno di sé per l'effetto massa che producono con la loro crescita, in una parte consistente dei casi il loro riscontro è incidentale contestualmente ad un esame diagnostico eseguito per altre cause. Gli adenomi secernenti invece spesso si associano a complicanze ormonali che ne portano alla diagnosi. Quando l’adenoma ipofisario è di notevoli dimensioni (macroadenoma) può crescere all’interno della cavità cranica e arrivare a comprimere il chiasmo ottico ed i nervi ottici portando così a deficit del campo visivo. Altri problemi visivi possono essere la perdita dell’acuità visiva, specialmente quando il macroadenoma cresce e arriva a comprimere il nervo ottico; oppure difficoltà nel percepire colori in modo vivido.
Clinica
Un altro aspetto della clinica è legata ad una possibile iper-secrezione ormonale o una soppressione della funzionalità della ghiandola ipofisaria (ipopituitarismo). L'ipersecrezione ormonale può portare alternativamente ad un quadro di ipertirodismo primario (quando il tumore produce l'ormone che stimola la tiroide), ipercortiolismo (quando il tumore produce l'ormone che stimola le ghiandole surrenali) generando diabete, ipertensione fragilità ossea e muscolare, iperprolattinemia (quando il tumore produce la prolattina che stimola la ghiandola mammaria a produrre secrezione lattea), acromegalia (aumento dimensionale delle estremità) o gigantismo (quando il tumore produce l'ormone della crescita). In particolare l'ipersecrezione di cortisolo è detta morbo di Cushing ed è spesso da correlarsi alla presenza di un microadenoma. Il possibile coinvolgimento dell'ipotalamo, la struttura immediatamente soprastante la ghiandola, può comportare alterazioni del comportamento alimentare (obesità ipotalamica), degli elettroliti nel sangue, del ciclo sonno-veglia, del senso della sete (diabete insipido, condizione che porta il paziente a perdere liquidi attraverso un aumento del volume urinario e a dover introdurre una enorme quantità di liquidi per compensare). In alcuni casi l'adenoma può andare incontro ad un sanguinamento nel suo contesto generando una compressione e sofferenza acuta della ghiandola ipofisaria con una conseguente insufficienza nella produzione degli ormoni fisiologici (insufficienza pituitarica o ipofisaria). Questa condizione è detta apoplessia ipofisaria e rappresenta una urgenza neurochirurgica se accompagnata da un calo improvviso del visus.
Diagnosi
La diagnosi è inizialmente clinica. Necessaria tuttavia è una conferma radiologica, attraverso la RM con mezzo di contrasto. I test ormonali sono utili per valutare il livello degli ormoni ipofisari, così da confermare se vi sia presenza di un eccesso di ormone prodotto dal tumore e la funzionalità della ghiandola stessa. Escludere la presenza di un prolattinoma è importante. Poiché il prolattinoma, caratterizzato da livelli molto elevati di prolattina nel sangue, è l'unico adenoma che si cura con una terapia medica. Tra gli esami diagnostici indicati vi sono:
- RM encefalo con e senza mezzo di contrasto
- Test ormonali
- Esami oculistici (campo visivo computerizzato, esame del fundus oculi, test dell'acuità visiva)
Terapia
- Chirurgia. Nella maggior parte dei casi di adenoma ipofisario non-secernente e in tutti i casi di adenomi secernenti, fatta eccezione per i prolattinomi, la rimozione chirurgica è l’approccio più efficace. Se il tumore ipofisario richiede l’intervento chirurgico, in genere l’approccio di scelta è la via trans-sfenoidale. L'approccio trans-sfenoidale un intervento minimamente invasivo, eseguito per via microchirurgica o endoscopica, che permette di rimuovere il tumore riducendo le possibili complicanze e i tempi di degenza. L'accesso chirurgico viene eseguito dal naso, attraverso una piccola incisione nella gengiva al di sotto del labbro superiore. Questa tecnica deve essere eseguita da chirurghi specializzati e necessita di tecnologie dedicate. Tumori di dimensioni maggiori ed estesi nella cavità cranica possono invece richiedere un intervento di chirurgia trancranica (craniotomia). La rimozione del tumore ha una doppia finalità: quella di risolvere l'effetto massa e effetto compressivo sulle strutture neurovascolari limitrofe al tumore e la cura endocrinologica all'iper-produzione di ormoni.
- Radiochirurgia. La radiochirurgia è indicata esclusivamente ai casi di recidiva post-chirurgica.
- Radioterapia. La radioterapia è indicata nei casi di adenomi aggressivi, plurirecidivi.
- Terapia medica. La terapia medica consiste nella terapia di soppressione ormonale nel caso degli adenomi secernenti; in particolare i prolattinomi hanno una terapia medica specifica a base di Cabergolina. Nei casi di insufficienza ipofisaria la terapia medica consiste nella sostituzione degli ormoni non più prodotti dalla ghiandola (terapia ormonale sostitutiva).
Prognosi
La prognosi degli adenomi ipofisari è generalmente buona. La chirurgia nella maggior parte dei casi è curativa con la guarigione del paziente. A volte è necessaria una seduta di radiochirurgia adiuvante (post-chirurgica) per controllare eventuali residui post-chirurgici. Si preferisce non rimuovere parti di tumore in intimo contatto con strutture vascolari o nervose. Così si riduce al minimo il rischio di morbidità operatoria e quindi di deficit neurologici del paziente. Anche in questi casi il controllo lesionale è ottimale. In seguito all'intervento si assiste di solito ad una normalizzazione del profilo ormonale e ad un miglioramento dei disturbi visivi, quando presenti. Estremamente rari sono i casi di adenomi aggressivi. Essi richiedono sedute di radioterapia convenzionale (tomoterapia) o approcci chemioterapici.
Un aneurisma cerebrale è una malformazione vascolare delle arterie cerebrali. Può avere un aspetto sacciforme o fusiforme. In particolare l'aneurisma sacciforme è tipicamente costituito da una porzione ristretta detta “colletto”. Questa collega il vaso da cui origina a una parte più allargata detta “cupola aneurismatica”. Gli aneurismi cerebrali sono lesioni acquisite, legate a un processo degenerativo, multifattoriale. Questo coinvolge il tessuto connettivo della parete del vaso. L’aterosclerosi, il fumo, l’ipertensione e il diabete giocano un ruolo importante nella sua evoluzione. Vi sono altre condizioni patologiche meno comuni a cui gli aneurismi cerebrali possono associarsi. Tra loro ci sono alcune malattie sistemiche del tessuto connettivo (e.g., Sindrome di Marfan).
Anatomia patologica
Le sedi più frequenti di sviluppo di un aneurisma sono a livello dell'arteria:
- carotide interna
- cerebrale media
- comunicante anteriore
- comunicante posteriore
Inizialmente l'aneurisma è accolto nello spazio subaracnoideo. Man mano che le sue dimensioni aumentano, esso prende contatto con le strutture nervose circostanti, generando potenziali effetti compressivi. Come detto, in base alla loro forma, gli aneurismi si distinguono in:
- Sacciformi
- Fusiformi
- Dissecanti (ovvero generati dallo slaminamento della parete del vaso)
Epidemiologia
La frequenza di riscontro di sanguinamento da rottura di un aneurisma cerebrale è di circa 5 nuovi casi all'anno ogni 100.000 abitanti. Tutte le età possono essere colpite con una prevalenza di incidenza tra i trenta e i sessant'anni di vita. Vi è una prevalenza del sesso femminile. Dopo un primo episodio emorragico (warning leak) le probabilità di nuove emorragie aumentano. Questo rende spesso necessario il trattamento dell'aneurisma. Il rischio di sanguinamento è, inoltre, aumentato nei cosiddetti casi familiari. La prevalenza dei casi di aneurismi nella popolazione generale è di circa il 5%. Un importante studio giapponese, chiamato studio ISUIA, ha attribuito il rischio percentuale cumulativo di sanguinamento in base alla dimensione, alla sede dell'aneurisma e alla storia clinica del paziente. Questo studio rappresenta a tutt'oggi un riferimento importante per l'indicazione terapeutica.
Clinica
- Nel 90% dei casi l'aneurisma si presenta con una emorragia subaracnoidea, secondaria alla rottura della sacca, caratterizzata da uno spandimento di sangue nello spazio subaracnoideo di variabile entità. I sintomi e segni correlati possono essere: cefalea intensa di tipo trafittivo (a colpo di pugnale), vomito, perdita di coscienza, deficit neurologici improvvisi, tra cui paralisi oculare, disturbi della vista, emiparesi. Nei casi più gravi vi è una compromissione dello stato di coscienza fino al coma e nei casi più gravi la morte improvvisa.
- Il restante 10% dei casi è di riscontro incidentale, poichè viene riscontrato nel corso di indagini cliniche eseguite per altri motivi. In questo caso, in base alle dimensioni della sacca, alla sua forma, alla sua locazione, ai vari fattori di rischio, il neurochirurgo o il neuroradiologo interventista suggeriranno o meno il trattamento.
Diagnosi
- TC ed Angio-TC. Il primo esame da eseguire in caso di emorragia da aneurisma cerebrale è la tomografia computerizzata. Con con le ricostruzioni tridimensionali attualmente possibili, essa permette di affrontare sia i problemi di emergenza (entità dell'emorragia, presenza di edema cerebrale, idrocefalo), sia una definizione dettagliata dell'aneurisma. Vengono evidenziati tutti i suoi rapporti con le strutture nervose e con i vasi arteriosi satelliti all'aneurisma stesso, elementi indispensabili per una corretta pianificazione terapeutica.
- ANGIOGRAFIA. L'angiografia dei vasi cerebrali è l'esame tradizionalmente utilizzato nella diagnosi degli aneurismi cerebrali. Si tratta di un esame invasivo in quanto si pratica con un cateterismo intravasale. Viene introdotto dall'arteria femorale in modo retrogrado lungo l'aorta sino ai vasi d'interesse (arterie carotidi e arterie vertebrali). Attraverso il catetere si inietta del mezzo di contrasto iodato. Si permette, in sintesi, la visualizzazione selettiva dei vasi interessati, studiandone le caratteristiche.
Trattamento
- Trattamento medico. Nelle prime ore dall'accesso in pronto soccorso, in base alla stadiazione clinica (gradi I-IV secondo Hunt e Hess), a quella radiologica (TC/angiografia), si procede per priorità al trattamento delle conseguenze dell'emorragia. Una volta assicurate le funzioni vitali del paziente, e valutata la necessità di un eventuale drenaggio ventricolare esterno, nel caso di idrocefalo acuto, si invia il paziente al successivo trattamento.
- Approccio endovascolare (coiling, stenting). Viene eseguito nelle unità di neuroradiologia interventistica ed è sempre più spesso considerato come l'opzione di primo livello. Esso consiste nel riempimento della sacca aneurismatica con piccole spirali metalliche (coil). In sintesi si esclude la sacca dal circolo sanguigno e si impedisce un nuovo sanguinamento. Per gli aneurismi non rotti, accanto alla embolizzazione, diviene sempre più frequente l'impiego di dispositivi a diversione di flusso (flow diverter). Si tratta di dispositivi simili a stent. Modificano l'emodinamica regionale, ricostruiscono l'endotelio vascolare e favoriscono la trombizzazione e la progressiva riduzione dimensionale dell'aneurisma.
- Approccio neurochirurgico (clipping). Il clipping chirurgico dell’aneurisma consiste nell’esclusione dell'aneurisma dal circolo cerebrale mediante l'applicazione di una (o più) "clip" sul colletto dell'aneurisma. Pur progressivamente sostituito dall'approccio endovascolare per la minore invasività, è ancora il trattamento di scelta nel caso in cui sia presente un voluminoso ematoma intracranico o negli aneurismi dell'arteria cerebrale media.
Complicanze e prognosi
- Idrocefalo Questo tipo di complicanza può essere trattata mediante il posizionamento di un drenaggio ventricolare esterno (DVE) e nei casi di idrocefalo cronico nel posizionamento di un sistema di derivazione ventricolo-peritoneale (DVP) o ventricolo-striale (DVA).
- Vasospasmo Rappresenta la complicanza più temibile, che consiste nella chiusura per spasmizzazione dei vasi cerebrali, come reazione all’irritazione generata dallo spandimento di sangue, con una conseguente riduzione di flusso e quindi ischemia di parti del cervello. Esso viene prevenuto mediante l'utilizzo di calcio-antagonisti (nimodipina). Il picco di incidenza maggiore del vasospasmo è tra il 7 e il 14 giorno dopo l'emorragia.
- Epilessia Complicanze meno frequenti sono le crisi epilettiche, che possono essere parziali o generalizzate.
La prognosi degli aneurismi cerebrali non rotti è buona, con buon recupero funzionale nei pazienti sottoposti a trattamento. Diverso è il caso di pazienti vittime di emorragia subaracnoidea. I postumi funzionali e neurologici possono essere estremamente severi ed invalidanti. Il rischio di mortalità e morbilità permanente resta estremamente elevato (40-50% dei casi).


